Απλές ουσίες είναι τα μέταλλα. Τύπος χημικού δεσμού στην απλή ουσία νάτριο
Όλες οι ουσίες, ανάλογα με την ικανότητά τους να μεταφέρουν ηλεκτρικό ρεύμα, χωρίζονται συμβατικά σε αγωγούς και οι ημιαγωγοί καταλαμβάνουν μια ενδιάμεση θέση μεταξύ τους Αγωγοί είναι μέταλλα, διαλύματα ή λιωμένα άλατα, οξέα και αλκάλια. Τα μέταλλα, λόγω των μοναδικών τους ιδιοτήτων ηλεκτρικής αγωγιμότητας, χρησιμοποιούνται ευρέως στην ηλεκτρική μηχανική Τα καλώδια από χαλκό και αλουμίνιο χρησιμοποιούνται κυρίως για τη μετάδοση ηλεκτρικής ενέργειας και σε εξαιρετικές περιπτώσεις, το ασήμι. Η ηλεκτρική καλωδίωση υποτίθεται ότι γίνεται μόνο με σύρματα χαλκού Τα καλώδια αλουμινίου εξακολουθούν να χρησιμοποιούνται λόγω του χαμηλού κόστους τους, καθώς και σε περιπτώσεις όπου η χρήση τους είναι απολύτως δικαιολογημένη και δεν αποτελεί κίνδυνο μια γνωστή εκ των προτέρων εγγυημένη ισχύς, για παράδειγμα, αντλίες, κλιματιστικά, ανεμιστήρες, οικιακές πρίζες με φορτίο έως 1 kW, καθώς και για εξωτερικές ηλεκτρικές καλωδιώσεις (εναέριες γραμμές, υπόγεια καλώδια κ.λπ.). Τα καλώδια επιτρέπονται στα σπίτια. Τα μέταλλα σε στερεά κατάσταση έχουν κρυσταλλική δομή Τα σωματίδια στους κρυστάλλους είναι διατεταγμένα με μια ορισμένη σειρά, σχηματίζοντας ένα χωρικό (κρυσταλλικό) πλέγμα. που δεν συνδέονται με τους πυρήνες των ατόμων τους Ροή ελεύθερων ηλεκτρονίων ονομάζονται αέριο ηλεκτρονίων, το μέταλλο είναι ηλεκτρικά ουδέτερο. Το συνολικό αρνητικό φορτίο όλων των ελεύθερων ηλεκτρονίων είναι ίσο με το θετικό φορτίο όλων των ιόντων του πλέγματος Ένα ηλεκτρικό πεδίο, τα ελεύθερα ηλεκτρόνια αρχίζουν διατεταγμένη κίνηση κατά μήκος του αγωγού το γεγονός ότι τα ηλεκτρόνια στα μέταλλα χρησιμεύουν ως φορείς ηλεκτρικού ρεύματος αποδείχθηκε με απλό πείραμα από τον Γερμανό φυσικό Karl Ricke το 1899. Πήρε τρεις κυλίνδρους της ίδιας ακτίνας: τον χαλκό. , αλουμίνιο και χαλκό, τα τοποθέτησε το ένα μετά το άλλο, τα πίεσε με τις άκρες τους και τα συμπεριέλαβε σε μια γραμμή τραμ και μετά πέρασε ηλεκτρικό ρεύμα μέσα από αυτά για περισσότερο από ένα χρόνο. Στη συνέχεια εξέτασε τα σημεία επαφής των μεταλλικών κυλίνδρων και δεν βρήκε άτομα αλουμινίου στον χαλκό, αλλά όχι άτομα χαλκού στο αλουμίνιο, δηλ. Δεν υπήρχε διάχυση Από αυτό συμπέρανε ότι όταν ένα ηλεκτρικό ρεύμα διέρχεται από έναν αγωγό, τα ιόντα παραμένουν ακίνητα και κινούνται μόνο τα ελεύθερα ηλεκτρόνια, τα οποία είναι ίδια για όλες τις ουσίες και δεν σχετίζονται με διαφορές στις φυσικοχημικές τους ιδιότητες. Έτσι, το ηλεκτρικό ρεύμα στους μεταλλικούς αγωγούς είναι η διατεταγμένη κίνηση των ελεύθερων ηλεκτρονίων υπό την επίδραση ενός ηλεκτρικού πεδίου ο αγωγός, κινείται με τεράστια ταχύτητα κοντά στην ταχύτητα του φωτός στο κενό (300.000 fps), εξαπλώνεται σε όλο το μήκος του αγωγού Ταυτόχρονα με τη διάδοση του ηλεκτρικού πεδίου, όλα τα ηλεκτρόνια αρχίζουν να κινούνται προς μία κατεύθυνση όλο το μήκος του αγωγού Έτσι, για παράδειγμα, όταν το κύκλωμα ενός ηλεκτρικού λαμπτήρα είναι κλειστό, αρχίζουν να κινούνται με τάξη και τα ηλεκτρόνια υπάρχουν στο πηνίο του λαμπτήρα. Όταν μιλούν για την ταχύτητα διάδοσης του ηλεκτρικού ρεύματος σε έναν αγωγό, εννοούν την ταχύτητα διάδοσης του ηλεκτρικού πεδίου κατά μήκος του αγωγού Ένα ηλεκτρικό σήμα που αποστέλλεται, για παράδειγμα, κατά μήκος των καλωδίων από τη Μόσχα στο Βλαδιβοστόκ (απόσταση περίπου 8000 km. ), φτάνει εκεί σε περίπου 0,03 δευτερόλεπτα. Τα διηλεκτρικά ή τα μονωτικά είναι ουσίες στις οποίες δεν υπάρχουν ελεύθεροι φορείς φόρτισης και επομένως δεν μεταφέρουν ηλεκτρικό ρεύμα Τέτοιες ουσίες ταξινομούνται ως ιδανικά διηλεκτρικά από αυτά τα υλικά έχουν ιοντική δομή, δηλ. αποτελούνται από θετικά και αρνητικά φορτισμένα ιόντα τα ηλεκτρικά τους φορτία είναι συνδεδεμένα σε ένα κρυσταλλικό πλέγμα και δεν είναι ελεύθερα, γεγονός που καθιστά αυτά τα υλικά διηλεκτρικά. Σε πραγματικές συνθήκες, τα διηλεκτρικά άγουν το ηλεκτρικό ρεύμα, όχι πολύ αδύναμα στα διηλεκτρικά δεσμεύονται σε σταθερά μόρια και δεν δηλώνουν, όπως στους αγωγούς, είναι εύκολο να αποκοπούν και να γίνουν ελεύθερα Το ηλεκτρικό ρεύμα που διέρχεται από τα διηλεκτρικά είναι ανάλογο με την ένταση του ηλεκτρικού πεδίου ισχύς, συμβαίνει ηλεκτρική διάσπαση Η τιμή ονομάζεται διηλεκτρική αντοχή του διηλεκτρικού και μετριέται σε V/cm. Οι ημιαγωγοί δεν διεξάγουν ηλεκτρικό ρεύμα σε χαμηλές τάσεις, αλλά όταν η τάση αυξάνεται, γίνονται ηλεκτρικά αγώγιμοι, σε αντίθεση με τους αγωγούς (μέταλλα), η αγωγιμότητα τους αυξάνεται με την αύξηση της θερμοκρασίας, για παράδειγμα, στα ραδιόφωνα τρανζίστορ καλά σε ζεστό καιρό. Οι ημιαγωγοί χαρακτηρίζονται από μια ισχυρή εξάρτηση της ηλεκτρικής αγωγιμότητας από εξωτερικές επιρροές Οι ημιαγωγοί χρησιμοποιούνται ευρέως σε διάφορες ηλεκτρικές συσκευές, καθώς η ηλεκτρική αγωγιμότητά τους μπορεί να ελεγχθεί.
Κατάλογος εργασιών.
Εργασίες 3. Περιοδικός πίνακας
Απάντηση:
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός στοιχείου σε περιόδους, οι μεταλλικές ιδιότητες των ατόμων μειώνονται και σε ομάδες αυξάνονται. Τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των μεταλλικών ιδιοτήτων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός στοιχείου σε περιόδους, οι μεταλλικές ιδιότητες των ατόμων μειώνονται και σε ομάδες αυξάνονται. Τακτοποιήστε κατά σειρά αύξησης των μεταλλικών ιδιοτήτων τα ακόλουθα στοιχεία:
Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός στοιχείου σε περιόδους, οι μεταλλικές ιδιότητες των ατόμων μειώνονται και σε ομάδες αυξάνονται. Τακτοποιήστε κατά σειρά αύξησης των μεταλλικών ιδιοτήτων τα ακόλουθα στοιχεία:
Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός στοιχείου σε περιόδους, οι μεταλλικές ιδιότητες των ατόμων μειώνονται και σε ομάδες αυξάνονται. Τακτοποιήστε κατά σειρά αύξησης των μεταλλικών ιδιοτήτων τα ακόλουθα στοιχεία:
Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός στοιχείου σε περιόδους, οι μεταλλικές ιδιότητες των ατόμων μειώνονται και σε ομάδες αυξάνονται. Τακτοποιήστε κατά σειρά αύξησης των μεταλλικών ιδιοτήτων τα ακόλουθα στοιχεία:
Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός στοιχείου σε περιόδους, οι μεταλλικές ιδιότητες των ατόμων μειώνονται και σε ομάδες αυξάνονται. Τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των μεταλλικών ιδιοτήτων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός στοιχείου σε περιόδους, οι μεταλλικές ιδιότητες των ατόμων μειώνονται και σε ομάδες αυξάνονται. Τακτοποιήστε κατά σειρά αύξησης των μεταλλικών ιδιοτήτων τα ακόλουθα στοιχεία:
Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός στοιχείου σε περιόδους, οι μεταλλικές ιδιότητες των ατόμων μειώνονται και σε ομάδες αυξάνονται. Τακτοποιήστε κατά σειρά αύξησης των μεταλλικών ιδιοτήτων τα ακόλουθα στοιχεία:
Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων στην επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αυξανόμενης ατομικής ακτίνας: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αυξανόμενης ατομικής ακτίνας: Καταγράψτε τα σημάδια των στοιχείων με την επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά φθίνουσας ατομικής ακτίνας: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την επιθυμητή ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, η ηλεκτραρνητικότητα των ατόμων αυξάνεται και σε ομάδες μειώνεται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης της ηλεκτραρνητικότητας: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με τη σωστή σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, η ηλεκτραρνητικότητα των ατόμων αυξάνεται και σε ομάδες μειώνεται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά φθίνουσας ηλεκτραρνητικότητας: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με τη σωστή σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των όξινων ιδιοτήτων των ανώτερων οξειδίων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι ο όξινος χαρακτήρας υψηλότερων οξειδίων στοιχείων αυξάνεται σε περιόδους με αυξανόμενο πυρηνικό φορτίο και μειώνεται σε ομάδες.
Λαμβάνοντας υπόψη αυτές τις κανονικότητες, τακτοποιήστε τα ακόλουθα στοιχεία με τη σειρά εξασθένησης των όξινων ιδιοτήτων των ανώτερων οξειδίων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι το οξύ
Ο χαρακτήρας των οξέων χωρίς οξυγόνο αυξάνεται με την αύξηση του φορτίου του ατομικού πυρήνα τόσο σε περιόδους όσο και σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τις ενώσεις υδρογόνου κατά σειρά αυξανόμενων όξινων ιδιοτήτων:
Στην απάντησή σας, να αναφέρετε τους αριθμούς των χημικών τύπων με τη σωστή σειρά.
Απάντηση:
Το περιοδικό σύστημα χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητες και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι η ευκολία της δωρεάς ηλεκτρονίων από άτομα στοιχείων σε περιόδους με αυξανόμενο πυρηνικό φορτίο μειώνεται και σε ομάδες αυξάνεται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αυξανόμενης ευκολίας απώλειας ηλεκτρονίων: Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη ακολουθία.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Περιοδικός πίνακας χημικών στοιχείων Δ.Ι. Το Mendeleev είναι ένα πλούσιο αποθετήριο πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους, τα μοτίβα των αλλαγών αυτών των ιδιοτήτων, τις μεθόδους λήψης ουσιών, καθώς και τη θέση τους στη φύση. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου σε περιόδους, οι ακτίνες των ατόμων μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά φθίνουσας ατομικής ακτίνας: N, Al, C, Si. Καταγράψτε τους χαρακτηρισμούς των στοιχείων με την απαιτούμενη σειρά.
Στην απάντησή σας, υποδείξτε τους χαρακτηρισμούς των στοιχείων που χωρίζονται με &. Για παράδειγμα, 11 & 22.
Απάντηση:
Περιοδικός πίνακας χημικών στοιχείων Δ.Ι. Το Mendeleev είναι ένα πλούσιο αποθετήριο πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του τακτικού αριθμού ενός χημικού στοιχείου, η βασική φύση του οξειδίου μειώνεται σε περιόδους και αυξάνεται σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αυξανόμενης βασικότητας των οξειδίων: Na, Al, Mg, B. Γράψτε τα σύμβολα των στοιχείων με την επιθυμητή ακολουθία.
Απάντηση:
Περιοδικός πίνακας χημικών στοιχείων Δ.Ι. Το Mendeleev είναι ένα πλούσιο αποθετήριο πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του τακτικού αριθμού ενός χημικού στοιχείου, η βασική φύση του οξειδίου μειώνεται σε περιόδους και αυξάνεται σε ομάδες. Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αυξανόμενης βασικότητας των οξειδίων: Mg, Al, K, Ca. Γράψτε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης της ηλεκτραρνητικότητας: χλώριο, πυρίτιο, θείο, φώσφορος. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αυξανόμενης αναγωγικής ικανότητας: ασβέστιο, νάτριο, μαγνήσιο, κάλιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά φθίνουσας ατομικής ακτίνας: αλουμίνιο, άνθρακας, βόριο, πυρίτιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των όξινων ιδιοτήτων των ανώτερων οξειδίων τους: πυρίτιο, χλώριο, φώσφορος, θείο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, οι βασικές ιδιότητες των οξειδίων εξασθενούν κατά περιόδους και εντείνονται σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αποδυνάμωσης των κύριων ιδιοτήτων των οξειδίων τους: αλουμίνιο, φώσφορος, μαγνήσιο, πυρίτιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Pe-ri-o-di-che-skaya si-ste-ma hi-mi-che-skih elements-men D. I. Men-de-le-e-va - κατάστημα god-ga-toe -Περισσότερες πληροφορίες για τα χημικά στοιχεία, τις ιδιότητες τους και τις ιδιότητες των ενώσεων τους. Έτσι, για παράδειγμα, είναι γνωστό ότι με την αύξηση του αριθμού των hi-mi-che-στοιχείων men-ta όξινων ιδιοτήτων των ανώτερων υδρο-βράχων-si-ds στο pe-ri-o-dah usi-li-va -et-sya, και σε ομάδες γάιδαρος-be-va- et.
Διδάξτε αυτούς τους νόμους, διευθετήστε τους για να ενισχύσετε τις όξινες ιδιότητες των ανώτερων υδριδίων τους: ροκ-λε-ράβδος, βόριο, βηρύλιο, άζωτο. Από αυτή την άποψη, υπάρχουν σύμβολα των στοιχείων στο απαραίτητο after-the-tele-no-sti.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του τακτικού αριθμού ενός χημικού στοιχείου, ο βασικός χαρακτήρας των υδροξειδίων εξασθενεί σε περιόδους και αυξάνεται σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά ενίσχυσης των βασικών ιδιοτήτων των υδροξειδίων τους: ασβέστιο, βηρύλλιο, στρόντιο, μαγνήσιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, η ικανότητα των ατόμων να δέχονται ηλεκτρόνια - ηλεκτραρνητικότητα - αυξάνεται σε περιόδους και εξασθενεί σε ομάδες.
Δεδομένων αυτών των μοτίβων, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά φθίνουσας ηλεκτραρνητικότητας: άζωτο, οξυγόνο, βόριο, άνθρακας. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, η ικανότητα των ατόμων να δίνουν ηλεκτρόνια - η αναγωγική ικανότητα - εξασθενεί σε περιόδους και αυξάνεται σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα μοτίβα, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά εξασθένησης της αναγωγικής ικανότητας: άζωτο, φθόριο, άνθρακας, οξυγόνο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, οι ακτίνες των ατόμων σε περιόδους μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: οξυγόνο, φθόριο, θείο, χλώριο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, η όξινη φύση των ανώτερων οξειδίων αυξάνεται κατά περιόδους και εξασθενεί σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αποδυνάμωσης των όξινων ιδιοτήτων των ανώτερων οξειδίων τους: πυρίτιο, χλώριο, φώσφορος, θείο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά ενίσχυσης των βασικών ιδιοτήτων των οξειδίων τους: αλουμίνιο, νάτριο, μαγνήσιο, πυρίτιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του τακτικού αριθμού ενός χημικού στοιχείου, οι όξινες ιδιότητες των ανώτερων υδροξειδίων (οξέων) αυξάνονται κατά περιόδους και εξασθενούν σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αποδυνάμωσης των όξινων ιδιοτήτων των ανώτερων υδροξειδίων τους: άνθρακας, βόριο, βηρύλλιο, άζωτο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, η ικανότητα των ατόμων να δέχονται ηλεκτρόνια - ηλεκτραρνητικότητα - αυξάνεται σε περιόδους και εξασθενεί σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αυξανόμενης ηλεκτραρνητικότητας: άζωτο, φθόριο, άνθρακας, οξυγόνο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, η ικανότητα δωρεάς ηλεκτρονίων - η αναγωγική ικανότητα - εξασθενεί σε περιόδους και αυξάνεται σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αυξανόμενης αναγωγικής ικανότητας: ρουβίδιο, νάτριο, λίθιο, κάλιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, οι ακτίνες των ατόμων σε περιόδους μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά φθίνουσας ατομικής ακτίνας: φώσφορος, άνθρακας, άζωτο, πυρίτιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, η όξινη φύση των ανώτερων οξειδίων αυξάνεται κατά περιόδους και εξασθενεί σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των όξινων ιδιοτήτων των ανώτερων οξειδίων τους: αλουμίνιο, θείο, πυρίτιο, φώσφορος. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, οι βασικές ιδιότητες των οξειδίων εξασθενούν σε περιόδους και αυξάνονται σε ομάδες.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά εξασθένησης των κύριων ιδιοτήτων των οξειδίων τους: μαγνήσιο, κάλιο, νάτριο, ασβέστιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, οι ακτίνες των ατόμων σε περιόδους μειώνονται και σε ομάδες αυξάνονται.
Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των ατομικών ακτίνων: άνθρακας, βόριο, βηρύλλιο, άζωτο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Το 2019 έχει ανακηρυχθεί Διεθνές Έτος του Περιοδικού Πίνακα Χημικών Στοιχείων από τον D. I. Mendeleev. Η παγκόσμια επιστημονική κοινότητα θα γιορτάσει την 150η επέτειο από την ανακάλυψη του Περιοδικού Νόμου των Χημικών Στοιχείων από τον D. I. Mendeleev το 1869. Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, οι ακτίνες των ατόμων σε περιόδους μειώνονται και σε ομάδες αυξάνονται. Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά φθίνουσας ατομικής ακτίνας: αλουμίνιο, φώσφορος, πυρίτιο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
Απάντηση:
Το 2019 έχει ανακηρυχθεί Διεθνές Έτος του Περιοδικού Πίνακα Χημικών Στοιχείων από τον D. I. Mendeleev. Η παγκόσμια επιστημονική κοινότητα θα γιορτάσει την 150η επέτειο από την ανακάλυψη του Περιοδικού Νόμου των Χημικών Στοιχείων από τον D. I. Mendeleev το 1869. Ο περιοδικός πίνακας χημικών στοιχείων του D.I Mendeleev είναι μια πλούσια αποθήκη πληροφοριών σχετικά με τα χημικά στοιχεία, τις ιδιότητές τους και τις ιδιότητες των ενώσεων τους. Για παράδειγμα, είναι γνωστό ότι με την αύξηση του ατομικού αριθμού ενός χημικού στοιχείου, η όξινη φύση των ανώτερων οξειδίων αυξάνεται κατά περιόδους και εξασθενεί σε ομάδες. Λαμβάνοντας υπόψη αυτά τα σχέδια, τακτοποιήστε τα ακόλουθα στοιχεία κατά σειρά αύξησης των όξινων ιδιοτήτων των ανώτερων οξειδίων τους: χλώριο, φώσφορος, θείο. Στην απάντησή σας, σημειώστε τα σύμβολα των στοιχείων με τη σωστή σειρά.
ΜΕΡΟΣ 1
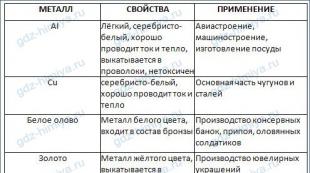
1. Εντοπίζονται μέταλλα (Μ).στις ομάδες I-III, ή στο κάτω μέρος των ομάδων IV-VI. Οι ομάδες Β αποτελούνται μόνο από μέταλλα.
2. Τα άτομα μετάλλου έχουν 1-3 ηλεκτρόνια στο εξωτερικό στρώμα ηλεκτρονίων και σχετικά μεγάλη ατομική ακτίνα.Τα άτομα μετάλλου τείνουν να χάνουν εξωτερικά ηλεκτρόνια.
3. Απλές ουσίες- τα μέταλλα αποτελούνται από στοιχεία που συνδέονται με έναν μεταλλικό χημικό δεσμό, ο οποίος μπορεί να αναπαρασταθεί από ένα γενικό διάγραμμα:
4. Όλα τα Μ είναι στερεά, εκτός από το Hg. Τα μαλακότερα μέταλλα είναι η ομάδα ΙΑ, το πιο σκληρό είναι το Cr.
5. Τα Μ έχουν θερμική και ηλεκτρική αγωγιμότητακαι έχουν μεταλλική γυαλάδα.
6. Ο κασσίτερος έχει την ιδιότητα να σχηματίζει δύο απλές ουσίες- λευκό και γκρι, δηλαδή η ιδιότητα της αλλοτροπίας.
7. Συμπληρώστε τον πίνακα «Ιδιότητες και εφαρμογές ορισμένων μετάλλων».

ΜΕΡΟΣ 2Ο
1. Επιλέξτε τα ονόματα απλών ουσιών - μετάλλων. Χρησιμοποιώντας τα γράμματα που αντιστοιχούν στις σωστές απαντήσεις, θα σχηματίσετε το όνομα του μετάλλου, που σημαίνει «πέτρα» στα ελληνικά: λίθιο.
2) μαγνήσιο L
3) ασβέστιο Ι
5) χαλκός Τ
7) χρυσός Ι
8) υδράργυρος J
2. Οι ακόλουθες δηλώσεις που χαρακτηρίζουν τα μέταλλα είναι εσφαλμένες:
5) μη πλαστικό και μη ελατό
3. Επιλέξτε τα τέσσερα πιο ηλεκτρικά αγώγιμα μέταλλα (τακτοποιήστε τους αριθμούς σε φθίνουσα σειρά ηλεκτρικής αγωγιμότητας) από τη λίστα:
1) ασήμι
2) χρυσός
3) αλουμίνιο
4) σίδερο
5) μαγγάνιο
6) Κάλιο
7) νάτριο
Απάντηση: 1, 2, 3, 7.
4. Να κάνετε διαγράμματα σχηματισμού μεταλλικών χημικών δεσμών για ουσίες με τους τύπους:

5. Αναλύστε το σχέδιο «Μεταλλικό κρυσταλλικό πλέγμα».

Εξάγετε ένα συμπέρασμα για τους λόγους της πλαστικότητας, της θερμικής και ηλεκτρικής αγωγιμότητας των μετάλλων.
Κάθε άτομο μετάλλου περιβάλλεται από οκτώ γειτονικά άτομα. Τα αποκολλημένα εξωτερικά ηλεκτρόνια κινούνται ελεύθερα από το ένα σχηματισμένο ιόν στο άλλο, συνδέοντας τον ιοντικό πυρήνα του μετάλλου σε ένα γιγάντιο μόριο. Η υψηλή θερμική αγωγιμότητα και η ηλεκτρική αγωγιμότητα των μετάλλων οφείλονται στην παρουσία στα κρυσταλλικά τους πλέγματα κινητών ηλεκτρονίων που κινούνται υπό την επίδραση ηλεκτρικού πεδίου. Τα περισσότερα μέταλλα είναι όλκιμα λόγω της μετατόπισης στρωμάτων ατόμων μετάλλου χωρίς να σπάνε οι δεσμοί μεταξύ τους.
6. Συμπληρώστε τον πίνακα «Μέταλλα». Βρείτε δεδομένα για τον πίνακα χρησιμοποιώντας πρόσθετες πηγές πληροφοριών, συμπεριλαμβανομένου του Διαδικτύου.

7. Χρησιμοποιώντας το Διαδίκτυο και άλλες πηγές πληροφοριών, ετοιμάστε ένα σύντομο μήνυμα με θέμα «Ο υδράργυρος στην ανθρώπινη ζωή» σύμφωνα με το ακόλουθο σχέδιο:
1) γνώση για τον υδράργυρο στην αρχαιότητα και τον Μεσαίωνα.
2) τοξικότητα του υδραργύρου και μέτρα ασφαλείας κατά την εργασία με αυτόν.
3) η χρήση του υδραργύρου στη σύγχρονη βιομηχανία.
1) Ο υδράργυρος ήταν ένα από τα 7 μέταλλα, θεωρείται ο προγονέας όλων των μετάλλων, όχι μόνο ο υδράργυρος, αλλά και το κράμα του, η κιννάβαρη.
2) Είναι πολύ τοξικό, εξατμίζεται σε θερμοκρασία δωματίου και δηλητηριάζει τον άνθρωπο αν εισπνευστεί. Συσσωρεύοντας στο σώμα, επηρεάζει τα εσωτερικά όργανα, τις αναπνευστικές οδούς, τα αιμοποιητικά όργανα και τον εγκέφαλο.
3) Ο υδράργυρος χρησιμοποιείται πολύ ευρέως. Στη χημική βιομηχανία ως κάθοδος στην παραγωγή υδροξειδίου του νατρίου, ως καταλύτης στην παραγωγή πολλών οργανικών ενώσεων, στη διάλυση μπλοκ ουρανίου (στην πυρηνική ενέργεια). Αυτό το στοιχείο χρησιμοποιείται στην κατασκευή λαμπτήρων φθορισμού, λαμπτήρων χαλαζία, μετρητών πίεσης, θερμομέτρων και άλλων επιστημονικών οργάνων.
I.V.TRIGUBCHAK
Καθηγητής Χημείας
ΜΑΘΗΜΑ 6
10η τάξη(πρώτο έτος σπουδών)
Συνέχιση. Για αρχή, βλέπε αρ. 22/2005. 1, 2, 3, 5/2006
Χημικός δεσμός. Δομή της ύλης
Σχέδιο
1. Χημικός δεσμός:
ομοιοπολικό (μη πολικό, πολικό, μονό, διπλό, τριπλό).
ιωνικός; μέταλλο; υδρογόνο; δυνάμεις διαμοριακής αλληλεπίδρασης.
2. Κρυσταλλικά πλέγματα (μοριακά, ιοντικά, ατομικά, μεταλλικά).
Διαφορετικές ουσίες έχουν διαφορετικές δομές. Από όλες τις ουσίες που είναι γνωστές μέχρι σήμερα, υπάρχουν μόνο αδρανή αέρια με τη μορφή ελεύθερων (απομονωμένων) ατόμων, γεγονός που οφείλεται στην υψηλή σταθερότητα των ηλεκτρονικών τους δομών. Όλες οι άλλες ουσίες (και πάνω από 10 εκατομμύρια από αυτές είναι επί του παρόντος γνωστές) αποτελούνται από συνδεδεμένα άτομα.
Ο χημικός δεσμός είναι οι δυνάμεις αλληλεπίδρασης μεταξύ ατόμων ή ομάδων ατόμων, που οδηγούν στο σχηματισμό μορίων, ιόντων, ελεύθερων ριζών, καθώς και ιοντικών, ατομικών και μεταλλικών κρυσταλλικών δικτύων. Από τη φύση του, ένας χημικός δεσμός είναι μια ηλεκτροστατική δύναμη. Ο κύριος ρόλος στο σχηματισμό χημικών δεσμών μεταξύ των ατόμων παίζεται από αυτά ηλεκτρόνια σθένους, δηλαδή ηλεκτρόνια του εξωτερικού επιπέδου, που είναι λιγότερο στενά συνδεδεμένα με τον πυρήνα. Κατά τη μετάβαση από την ατομική κατάσταση στη μοριακή κατάσταση, απελευθερώνεται ενέργεια που σχετίζεται με την πλήρωση ελεύθερων τροχιακών του εξωτερικού ηλεκτρονικού επιπέδου με ηλεκτρόνια σε μια ορισμένη σταθερή κατάσταση.
Υπάρχουν διάφοροι τύποι χημικών δεσμών.
Ο ομοιοπολικός δεσμός είναι ένας χημικός δεσμός που προκύπτει μέσω της κοινής χρήσης ζευγών ηλεκτρονίων. Η θεωρία των ομοιοπολικών δεσμών προτάθηκε το 1916 από τον Αμερικανό επιστήμονα Gilbert Lewis. Τα περισσότερα μόρια, μοριακά ιόντα, ελεύθερες ρίζες και ατομικά κρυσταλλικά πλέγματα σχηματίζονται μέσω ομοιοπολικών δεσμών. Ένας ομοιοπολικός δεσμός χαρακτηρίζεται από μήκος (η απόσταση μεταξύ των ατόμων), κατεύθυνση (ορισμένος χωρικός προσανατολισμός των νεφών ηλεκτρονίων κατά το σχηματισμό ενός χημικού δεσμού), κορεσμός (η ικανότητα των ατόμων να σχηματίζουν έναν ορισμένο αριθμό ομοιοπολικών δεσμών), ενέργεια ( την ποσότητα ενέργειας που πρέπει να δαπανηθεί για να σπάσει ένας χημικός δεσμός).
Ένας ομοιοπολικός δεσμός μπορεί να είναι μη πολικόΚαι πολικός. Μη πολικός ομοιοπολικός δεσμόςεμφανίζεται μεταξύ ατόμων με την ίδια ηλεκτραρνητικότητα (EO) (H 2, O 2, N 2, κ.λπ.). Σε αυτή την περίπτωση, το κέντρο της συνολικής πυκνότητας ηλεκτρονίων βρίσκεται στην ίδια απόσταση από τους πυρήνες και των δύο ατόμων. Με βάση τον αριθμό των κοινών ζευγών ηλεκτρονίων (δηλαδή της πολλαπλότητας), διακρίνονται οι απλοί, οι διπλοί και οι τριπλοί ομοιοπολικοί δεσμοί. Εάν σχηματίζεται μόνο ένα κοινό ζεύγος ηλεκτρονίων μεταξύ δύο ατόμων, τότε ένας τέτοιος ομοιοπολικός δεσμός ονομάζεται απλός δεσμός. Εάν εμφανιστούν δύο ή τρία κοινά ζεύγη ηλεκτρονίων μεταξύ δύο ατόμων, σχηματίζονται πολλαπλοί δεσμοί - διπλοί και τριπλοί. Ένας διπλός δεσμός αποτελείται από έναν δεσμό και έναν δεσμό. Ένας τριπλός δεσμός αποτελείται από έναν δεσμό και δύο δεσμούς.
Οι ομοιοπολικοί δεσμοί, κατά το σχηματισμό των οποίων η περιοχή των επικαλυπτόμενων νεφών ηλεκτρονίων βρίσκεται στη γραμμή που συνδέει τους πυρήνες των ατόμων, ονομάζονται - συνδέσεις. Οι ομοιοπολικοί δεσμοί, κατά τον σχηματισμό των οποίων η περιοχή των επικαλυπτόμενων νεφών ηλεκτρονίων βρίσκεται και στις δύο πλευρές της γραμμής που συνδέει τους πυρήνες των ατόμων, ονομάζονται - συνδέσεις.
Μπορεί να συμμετέχει στο σχηματισμό συνδέσεων μικρό- Και μικρό-ηλεκτρόνια (H 2), μικρό- Και Π-ηλεκτρόνια (HCl), R- Και
R-ηλεκτρόνια (Cl 2). Επιπλέον, μπορούν να σχηματιστούν δεσμοί λόγω της επικάλυψης «καθαρών» και υβριδικών τροχιακών. Μόνο R- Και ρε-ηλεκτρόνια.
Οι παρακάτω γραμμές δείχνουν τους χημικούς δεσμούς στα μόρια του υδρογόνου, του οξυγόνου και του αζώτου:
όπου τα ζεύγη κουκκίδων (:) είναι ζευγαρωμένα ηλεκτρόνια. «σταυροί» (x) – ασύζευκτα ηλεκτρόνια.
Εάν σχηματίζεται ομοιοπολικός δεσμός μεταξύ ατόμων με διαφορετική EO, τότε το κέντρο της συνολικής πυκνότητας ηλεκτρονίων μετατοπίζεται προς το άτομο με υψηλότερο EO. Σε αυτή την περίπτωση υπάρχει ομοιοπολικός πολικός δεσμός. Ένα διατομικό μόριο που συνδέεται με έναν ομοιοπολικό πολικό δεσμό είναι ένα δίπολο - ένα ηλεκτρικά ουδέτερο σύστημα στο οποίο τα κέντρα θετικών και αρνητικών φορτίων βρίσκονται σε μια ορισμένη απόσταση το ένα από το άλλο.
Η γραφική άποψη των χημικών δεσμών στα μόρια του υδροχλίου και του νερού είναι η εξής:
όπου τα βέλη δείχνουν τη μετατόπιση της ολικής πυκνότητας ηλεκτρονίων.
Οι πολικοί και μη πολικοί ομοιοπολικοί δεσμοί σχηματίζονται από έναν μηχανισμό ανταλλαγής. Επιπλέον, υπάρχουν ομοιοπολικούς δεσμούς δότη-δέκτη.Ο μηχανισμός σχηματισμού τους είναι διαφορετικός. Σε αυτή την περίπτωση, ένα άτομο (δότης) παρέχει ένα μοναχικό ζεύγος ηλεκτρονίων, το οποίο γίνεται το κοινό ζεύγος ηλεκτρονίων μεταξύ του ίδιου και ενός άλλου ατόμου (δέκτης). Όταν σχηματίζεται ένας τέτοιος δεσμός, ο δέκτης παρέχει ένα ελεύθερο τροχιακό ηλεκτρονίων.
Ο μηχανισμός δότη-δέκτη του σχηματισμού ομοιοπολικού δεσμού απεικονίζεται χρησιμοποιώντας το παράδειγμα του σχηματισμού ιόντων αμμωνίου:

Έτσι, στο ιόν αμμωνίου, και οι τέσσερις δεσμοί είναι ομοιοπολικοί. Τρία από αυτά σχηματίζονται από τον μηχανισμό ανταλλαγής, ένα από τον μηχανισμό δότη-δέκτη. Και οι τέσσερις συνδέσεις είναι ισοδύναμες, κάτι που οφείλεται sp 3 -υβριδισμός των τροχιακών του ατόμου του αζώτου. Το σθένος του αζώτου στο ιόν αμμωνίου είναι IV, επειδή σχηματίζει τέσσερις δεσμούς. Κατά συνέπεια, εάν ένα στοιχείο σχηματίζει δεσμούς τόσο μέσω μηχανισμών ανταλλαγής όσο και μέσω μηχανισμών δότη-δέκτη, τότε το σθένος του είναι μεγαλύτερο από τον αριθμό των μη ζευγαρωμένων ηλεκτρονίων και καθορίζεται από τον συνολικό αριθμό των τροχιακών στο εξωτερικό ηλεκτρονικό στρώμα. Ειδικά για το άζωτο, το υψηλότερο σθένος είναι τέσσερα.
Ιοντικός δεσμός – χημικός δεσμός μεταξύ ιόντων λόγω των δυνάμεων της ηλεκτροστατικής έλξης. Ένας ιοντικός δεσμός σχηματίζεται μεταξύ ατόμων με μεγάλη διαφορά EO (> 1,7). Με άλλα λόγια, είναι ο δεσμός μεταξύ τυπικών μετάλλων και τυπικών αμετάλλων. Η θεωρία του ιοντικού δεσμού προτάθηκε το 1916 από τον Γερμανό επιστήμονα Walter Kossel. Εγκαταλείποντας τα ηλεκτρόνια τους, τα άτομα μετάλλου μετατρέπονται σε θετικά φορτισμένα ιόντα - κατιόντα; Τα μη μεταλλικά άτομα, που δέχονται ηλεκτρόνια, μετατρέπονται σε αρνητικά φορτισμένα ιόντα - ανιόντα. Μια ηλεκτροστατική έλξη εμφανίζεται μεταξύ των ιόντων που προκύπτουν, η οποία ονομάζεται ιονικός δεσμός. Ο ιοντικός δεσμός χαρακτηρίζεται από μη κατευθυντικότητα και μη κορεσμό. Για τις ιοντικές ενώσεις, η έννοια του "μορίου" δεν έχει νόημα. Στο κρυσταλλικό πλέγμα των ιοντικών ενώσεων, γύρω από κάθε ιόν υπάρχει ένας ορισμένος αριθμός ιόντων με αντίθετα φορτία. Οι ενώσεις NaCl και FeS χαρακτηρίζονται από ένα κυβικό κρυσταλλικό πλέγμα.
Ο σχηματισμός ενός ιοντικού δεσμού απεικονίζεται παρακάτω χρησιμοποιώντας χλωριούχο νάτριο ως παράδειγμα:

Ένας ιονικός δεσμός είναι μια ακραία περίπτωση πολικού ομοιοπολικού δεσμού. Δεν υπάρχει αιχμηρό όριο μεταξύ τους ο τύπος του δεσμού μεταξύ των ατόμων καθορίζεται από τη διαφορά στην ηλεκτραρνητικότητα των στοιχείων.
Όταν σχηματίζονται απλές ουσίες - μέταλλα - τα άτομα εγκαταλείπουν πολύ εύκολα ηλεκτρόνια από το εξωτερικό ηλεκτρονικό επίπεδο. Έτσι, στους κρυστάλλους μετάλλων, μερικά από τα άτομα τους βρίσκονται σε ιονισμένη κατάσταση. Στους κόμβους του κρυσταλλικού πλέγματος υπάρχουν θετικά φορτισμένα μεταλλικά ιόντα και άτομα, και μεταξύ τους υπάρχουν ηλεκτρόνια που μπορούν να κινούνται ελεύθερα σε όλο το κρυσταλλικό πλέγμα. Αυτά τα ηλεκτρόνια γίνονται κοινά σε όλα τα άτομα και τα ιόντα του μετάλλου και ονομάζονται «αέριο ηλεκτρονίων». Ο δεσμός μεταξύ όλων των θετικά φορτισμένων μεταλλικών ιόντων και των ελεύθερων ηλεκτρονίων στο μεταλλικό κρυσταλλικό πλέγμα ονομάζεται μεταλλικός δεσμός.
Η παρουσία ενός μεταλλικού δεσμού καθορίζει τις φυσικές ιδιότητες των μετάλλων και των κραμάτων: σκληρότητα, ηλεκτρική αγωγιμότητα, θερμική αγωγιμότητα, ελατότητα, ολκιμότητα, μεταλλική λάμψη. Τα ελεύθερα ηλεκτρόνια μπορούν να μεταφέρουν θερμότητα και ηλεκτρισμό, επομένως είναι ο λόγος για τις κύριες φυσικές ιδιότητες που διακρίνουν τα μέταλλα από τα αμέταλλα - υψηλή ηλεκτρική και θερμική αγωγιμότητα.
Δεσμός υδρογόνουεμφανίζεται μεταξύ μορίων που περιέχουν υδρογόνο και ατόμων με υψηλή EO (οξυγόνο, φθόριο, άζωτο). Οι ομοιοπολικοί δεσμοί H–O, H–F, H–N είναι εξαιρετικά πολικοί, εξαιτίας των οποίων συσσωρεύεται περίσσεια θετικού φορτίου στο άτομο υδρογόνου και περίσσεια αρνητικού φορτίου στους αντίθετους πόλους. Ανάμεσα σε αντίθετα φορτισμένους πόλους, προκύπτουν δυνάμεις ηλεκτροστατικής έλξης - δεσμοί υδρογόνου. Οι δεσμοί υδρογόνου μπορεί να είναι είτε διαμοριακούς είτε ενδομοριακούς. Η ενέργεια ενός δεσμού υδρογόνου είναι περίπου δέκα φορές μικρότερη από την ενέργεια ενός συμβατικού ομοιοπολικού δεσμού, αλλά παρόλα αυτά, οι δεσμοί υδρογόνου παίζουν σημαντικό ρόλο σε πολλές φυσικοχημικές και βιολογικές διεργασίες. Συγκεκριμένα, τα μόρια DNA είναι διπλές έλικες στις οποίες δύο αλυσίδες νουκλεοτιδίων συνδέονται με δεσμούς υδρογόνου.
Τραπέζι
| Χαρακτηριστικό του κρυσταλλικού πλέγματος | Τύπος δικτυωτό | |||
|---|---|---|---|---|
| Μοριακός | ιωνικός | Πυρηνικός | Μέταλλο | |
| Σωματίδια σε κόμβους πλέγματος | Μόρια | Κατιόντα και ανιόντα | Άτομα | Κατιόντα και άτομα μετάλλων |
| Η φύση της σύνδεσης μεταξύ των σωματιδίων | Δυνάμεις διαμοριακής αλληλεπίδρασης (συμπεριλαμβανομένων των δεσμών υδρογόνου) | Ιωνικοί δεσμοί | Ομοιοπολικούς δεσμούς | Μεταλλική σύνδεση |
| Δύναμη δεσμού | Αδύναμος | Διαρκής | Πολύ ανθεκτικό | Διάφορες δυνάμεις |
| Διακεκριμένες φυσικές ιδιότητες ουσιών | Χαμηλή τήξη ή εξάχνωση, χαμηλή σκληρότητα, πολλά διαλυτά στο νερό | Πυρίμαχα, σκληρά, πολλά διαλυτά στο νερό. Τα διαλύματα και τα τήγματα άγουν ηλεκτρικό ρεύμα | Πολύ πυρίμαχο, πολύ σκληρό, πρακτικά αδιάλυτο στο νερό | Υψηλή ηλεκτρική και θερμική αγωγιμότητα, μεταλλική λάμψη |
| Παραδείγματα ουσιών | Ιώδιο, νερό, ξηρός πάγος | Χλωριούχο νάτριο, υδροξείδιο του καλίου, νιτρικό βάριο | Διαμάντι, πυρίτιο, βόριο, γερμάνιο | Χαλκός, κάλιο, ψευδάργυρος, σίδηρος |
Οι διαμοριακοί δεσμοί υδρογόνου μεταξύ μορίων νερού και υδροφθορίου μπορούν να απεικονιστούν (με κουκκίδες) ως εξής:

Οι ουσίες με δεσμούς υδρογόνου έχουν μοριακά κρυσταλλικά πλέγματα. Η παρουσία δεσμού υδρογόνου οδηγεί στο σχηματισμό μοριακών συσχετισμών και, κατά συνέπεια, σε αύξηση των σημείων τήξης και βρασμού.
Εκτός από τους αναφερόμενους κύριους τύπους χημικών δεσμών, υπάρχουν επίσης καθολικές δυνάμεις αλληλεπίδρασης μεταξύ οποιωνδήποτε μορίων που δεν οδηγούν στη θραύση ή στο σχηματισμό νέων χημικών δεσμών. Αυτές οι αλληλεπιδράσεις ονομάζονται δυνάμεις van der Waals. Καθορίζουν την έλξη των μορίων μιας δεδομένης ουσίας (ή διαφόρων ουσιών) μεταξύ τους σε υγρή και στερεή κατάσταση συσσωμάτωσης.
Διαφορετικοί τύποι χημικών δεσμών καθορίζουν την ύπαρξη διαφορετικών τύπων κρυσταλλικών δικτυωμάτων (πίνακας).
Ουσίες που αποτελούνται από μόρια έχουν μοριακή δομή. Αυτές οι ουσίες περιλαμβάνουν όλα τα αέρια, τα υγρά, καθώς και τα στερεά με μοριακό κρυσταλλικό πλέγμα, όπως το ιώδιο. Στερεά με ατομικό, ιοντικό ή μεταλλικό πλέγμα έχουν μη μοριακή δομή, δεν έχουν μόρια.
Δοκιμή με θέμα «Χημικός δεσμός. Δομή της ύλης"
1. Πόσα ηλεκτρόνια συμμετέχουν στο σχηματισμό χημικών δεσμών σε ένα μόριο αμμωνίας;
Α2; β) 6; στις 8; δ) 10.
2. Τα στερεά με ιοντικό κρυσταλλικό πλέγμα χαρακτηρίζονται από χαμηλό:
α) σημείο τήξης· β) δεσμευτική ενέργεια.
γ) διαλυτότητα στο νερό. δ) αστάθεια.
3. Τακτοποιήστε τις παρακάτω ουσίες κατά σειρά αυξανόμενης πολικότητας των ομοιοπολικών δεσμών. Στην απάντησή σας, αναφέρετε τη σειρά των γραμμάτων.
α) S 8; β) SO 2; γ) H2S; δ) SF 6.
4. Ποια σωματίδια σχηματίζουν έναν κρύσταλλο νιτρικού νατρίου;
α) άτομα Na, N, O. β) ιόντα Na +, N 5+, O 2–;
γ) Μόρια NaNO 3. δ) Na +, NO 3 – ιόντα.
5. Να αναφέρετε τις ουσίες που έχουν ατομικά κρυσταλλικά πλέγματα σε στερεά κατάσταση:
ένα διαμάντι; β) χλώριο.
γ) οξείδιο του πυριτίου (IV). δ) οξείδιο του ασβεστίου.
6. Υποδείξτε το μόριο με την υψηλότερη ενέργεια δέσμευσης:
α) υδροφθόριο. β) υδροχλώριο.
γ) υδροβρώμιο. δ) υδροϊωδιούχο.
7. Επιλέξτε ζεύγη ουσιών στα οποία όλοι οι δεσμοί είναι ομοιοπολικοί:
α) NaCl, HCl; β) CO 2, NO;
γ) CH3Cl, CH3K; δ) SO 2, NO 2.
8. Σε ποια σειρά είναι διατεταγμένα τα μόρια κατά σειρά αυξανόμενης πολικότητας δεσμού;
α) HBr, HCl, HF; β) NH 3, PH 3, AsH 3;
γ) H2Se, H2S, H2O; δ) CO 2, CS 2, CSe 2.
9. Μια ουσία της οποίας τα μόρια περιέχουν πολλαπλούς δεσμούς είναι:
α) διοξείδιο του άνθρακα. β) χλώριο;
γ) νερό? δ) αιθανόλη.
10. Ποια φυσική ιδιότητα δεν επηρεάζεται από το σχηματισμό διαμοριακών δεσμών υδρογόνου;
α) ηλεκτρική αγωγιμότητα.
β) πυκνότητα.
γ) σημείο βρασμού.
δ) σημείο τήξης.
Κλειδί για τη δοκιμή
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| σι | σολ | Α Β Γ Δ | σολ | μετα Χριστον | ΕΝΑ | β, δ | μετα Χριστον | ΕΝΑ | ΕΝΑ |
Προβλήματα σε αέρια και μείγματα αερίων
Επίπεδο Α
1. Το αέριο οξείδιο του θείου σε θερμοκρασία 60 °C και πίεση 90 kPa έχει πυκνότητα 2,08 g/l. Προσδιορίστε τον τύπο του οξειδίου.
Απάντηση. SO2.
2. Να βρείτε τα κλάσματα όγκου υδρογόνου και ηλίου σε ένα μείγμα του οποίου η σχετική πυκνότητα στον αέρα είναι 0,1.
Απάντηση. 55% και 45%.
3. Κάψαμε 50 λίτρα μείγματος υδρόθειου και οξυγόνου με σχετική πυκνότητα υδρογόνου 16,2. Η προκύπτουσα ουσία πέρασε μέσω 25 ml διαλύματος υδροξειδίου του νατρίου 25% (η πυκνότητα του διαλύματος είναι 1280 kg/m3). Προσδιορίστε τη μάζα του προκύπτοντος όξινου άλατος.
Απάντηση. 20,8 γρ.
4. Ένα μίγμα νιτρικού νατρίου και ανθρακικού ασβεστίου αποσυντέθηκε θερμικά. Τα αέρια που προέκυψαν (όγκος 11,2 λίτρα) στο μίγμα είχαν σχετική πυκνότητα υδρογόνου 16,5. Προσδιορίστε τη μάζα του αρχικού μείγματος.
Απάντηση. '82
5. Με ποια γραμμομοριακή αναλογία αργού και αζώτου μπορεί να ληφθεί ένα μείγμα αερίων με πυκνότητα ίση με αυτή του αέρα;
Το αρχικό μείγμα περιέχει Ar και N 2 .
Σύμφωνα με τις συνθήκες του προβλήματος (μίγμα) = (αέρας).
Μ(αέρας) = Μ(μείγματα) = 29 g/mol.
![]()
Χρησιμοποιώντας τη συνήθη αναλογία:
παίρνουμε την εξής έκφραση:
![]()
Άσε (μίγμα) = 1 mol. Τότε (Αρ) = Χ mol, (N 2) = (1 - Χ) ΕΛΙΑ δερματος.

Απάντηση. (Ar) : (N 2) = 1: 11.
6. Η πυκνότητα του μείγματος αερίων που αποτελείται από άζωτο και οξυγόνο είναι 1,35 g/l. Βρείτε τα κλάσματα όγκου των αερίων στο μείγμα σε %.
Απάντηση. 44% και 56%.
7. Ο όγκος του μείγματος που περιέχει υδρογόνο και χλώριο είναι 50 ml. Μετά το σχηματισμό του υδροχλωρίου, παραμένουν 10 ml χλωρίου. Βρείτε τη σύνθεση του αρχικού μείγματος σε % κατ' όγκο.
Απάντηση. 40% και 60%.
Απάντηση. 3%.
9. Όταν προστίθεται ποιο αέριο σε μείγμα ίσων όγκων μεθανίου και διοξειδίου του άνθρακα, η πυκνότητα υδρογόνου του: α) θα αυξηθεί. β) θα μειωθεί; Δώστε δύο παραδείγματα σε κάθε περίπτωση.
Απάντηση.
Μ(μείγματα CH 4 και CO 2) = 30 g/mol. α) Cl 2 και O 2; β) N 2 και H 2.
10.
Υπάρχει ένα μείγμα αμμωνίας και οξυγόνου. Όταν προσθέτουμε ποιο αέριο σε αυτό το μείγμα, η πυκνότητά του είναι:
α) θα αυξηθεί· β) θα μειωθεί; Δώστε δύο παραδείγματα σε κάθε περίπτωση.
Απάντηση.
17 < Κύριος(μείγματα NH 3 + O 2)< 32; а) Cl 2
и C 4 H 10 ; б) H 2 и Нe.
11. Ποια είναι η μάζα 1 λίτρου μείγματος διοξειδίου του άνθρακα και διοξειδίου του άνθρακα εάν η περιεκτικότητα του πρώτου αερίου είναι 35% κατ' όγκο;
Απάντηση. 1,7 γρ.
12. 1 λίτρο μείγματος διοξειδίου του άνθρακα και διοξειδίου του άνθρακα στο αρ. έχει μάζα 1,43 g Προσδιορίστε τη σύσταση του μείγματος σε % κατ' όγκο.
Απάντηση. 74,8% και 25,2%.
Επίπεδο Β
1. Προσδιορίστε τη σχετική πυκνότητα του αέρα από το άζωτο εάν όλο το οξυγόνο που περιέχεται στον αέρα μετατρέπεται σε όζον (υποθέστε ότι ο αέρας περιέχει μόνο άζωτο και οξυγόνο).
Απάντηση. 1,03.
2. Όταν ένα πολύ κοινό αέριο Α εισάγεται σε ένα γυάλινο δοχείο που περιέχει αέριο Β, το οποίο έχει την ίδια πυκνότητα με το αέριο Α, παραμένει μόνο υγρή άμμος στο δοχείο. Προσδιορίστε τα αέρια. Να γράψετε εξισώσεις για εργαστηριακές μεθόδους απόκτησής τους.
Απάντηση. A – O 2, B – SiH 4.
2NaNO 3 2NaNO 2 + O 2,
Mg 2 Si + 4H 2 O = 2 Mg (OH) 2 + SiH 4.
3. Σε ένα αέριο μείγμα αποτελούμενο από διοξείδιο του θείου και οξυγόνο, με σχετική πυκνότητα για το υδρογόνο 24, μέρος του διοξειδίου του θείου αντέδρασε και σχηματίστηκε ένα αέριο μείγμα με σχετική πυκνότητα για το υδρογόνο 25% μεγαλύτερη από τη σχετική πυκνότητα του αρχικού μείγματος . Υπολογίστε τη σύνθεση του μείγματος ισορροπίας σε % κατ' όγκο.
Απάντηση. 50% SO 3, 12,5% SO 2, 37,5% O 2.
4. Η πυκνότητα του οζονισμένου οξυγόνου σύμφωνα με το όζον είναι 0,75. Πόσα λίτρα οζονισμένου οξυγόνου θα χρειαστούν για να καούν 20 λίτρα μεθανίου;
Απάντηση. 35,5 λίτρα.
5. Υπάρχουν δύο δοχεία γεμάτα με μείγματα αερίων: α) υδρογόνο και χλώριο. β) υδρογόνο και οξυγόνο. Θα αλλάξει η πίεση στα δοχεία όταν ένας ηλεκτρικός σπινθήρας περάσει μέσα από αυτά τα μείγματα;
Απάντηση. α) Δεν θα αλλάξει. β) θα μειωθεί.
(CaSO 3) = 1 mol,
Επειτα y= (Ca(HCO 3) 2) = 5 mol.

Το προκύπτον μίγμα αερίων περιέχει SO 2 και CO 2.

Απάντηση. ρεαέρας (μείγματα) = 1,58.
7. Ο όγκος του μείγματος μονοξειδίου του άνθρακα και οξυγόνου είναι 200 ml (n.s.). Μετά από όλα, το μονοξείδιο του άνθρακα έχει καεί και έχει τεθεί σε κανονικές συνθήκες. ο όγκος του μίγματος μειώθηκε στα 150 ml. Πόσες φορές θα μειωθεί ο όγκος του μείγματος αερίων αφού το περάσουμε από 50 g διαλύματος υδροξειδίου του καλίου 2%;
Απάντηση. 3 φορές.
ΜΕΡΟΣ Α. Τεστ Πολλαπλής Επιλογής
1. Κατανομή ηλεκτρονίων ανά ενεργειακά επίπεδα σε ένα άτομο λιθίου:
2. Ο αριθμός των ηλεκτρονίων στο εξωτερικό στρώμα ηλεκτρονίων των ατόμων αλκαλιμετάλλου:
3. Τύπος χημικού δεσμού στην απλή ουσία νάτριο:

4. Μια απλή ουσία με τις πιο έντονες μεταλλικές ιδιότητες:
5. Ακτίνα ατόμων στοιχείων της κύριας υποομάδας με αυξανόμενο πυρηνικό φορτίο:

6. Ένα άτομο ασβεστίου διαφέρει από ένα ιόν ασβεστίου:

7. Αντιδρά πιο έντονα με το νερό:
8. Δεν αλληλεπιδρά με το υδροχλωρικό οξύ:
9. Το υδροξείδιο του αργιλίου αλληλεπιδρά με μια ουσία της οποίας ο τύπος είναι:
10. Μια σειρά στην οποία όλες οι ουσίες αντιδρούν με τον σίδηρο:

ΜΕΡΟΣ Β. Ερωτήσεις χωρίς απάντηση
11. Προτείνετε τρεις τρόπους λήψης υδροξειδίου του ασβεστίου. Επιβεβαιώστε την απάντησή σας με εξισώσεις αντίδρασης.

12. Να αναγνωρίσετε τις ουσίες Χ, Υ, Ζ, να σημειώσετε τους χημικούς τους τύπους.

13. Πώς, χρησιμοποιώντας οποιαδήποτε αντιδραστήρια (ουσίες) και λίθιο, να ληφθεί ένα οξείδιο, βάση, άλας; Να γράψετε τις εξισώσεις αντίδρασης σε μοριακή μορφή.

14. Τακτοποιήστε τα μέταλλα: αλουμίνιο, μόλυβδος, χρυσός, χαλκός κατά σειρά αυξανόμενης σχετικής ηλεκτρικής αγωγιμότητας (Εικ. 2).