Энгийн бодисууд нь металл юм. Энгийн натрийн бодис дахь химийн бондын төрөл
Бүх бодисыг цахилгаан гүйдэл дамжуулах чадварын дагуу дамжуулагч ба диэлектрик гэж хуваадаг. Дамжуулагч нь металл, уусмал эсвэл хайлсан давс, хүчил, шүлт юм. Металл нь цахилгаан дамжуулалтын өвөрмөц шинж чанараас шалтгаалан цахилгаан эрчим хүчийг дамжуулахад ихэвчлэн зэс, хөнгөн цагаан утас, 2001 оноос хойш ашиглагддаг. Цахилгааны утсыг зөвхөн зэс утсаар хийх ёстой гэж үздэг бөгөөд хөнгөн цагаан утсыг ашиглах нь бүрэн үндэслэлтэй бөгөөд аюул учруулахгүй тохиолдолд суурин хэрэглэгчдэд зориулагдсан байдаг Урьдчилан мэдэгдэж байгаа баталгаатай хүч, жишээлбэл, насос, агааржуулагч, сэнс, 1 кВт хүртэл ачаалалтай гэр ахуйн залгуурууд, түүнчлэн гадаад цахилгааны утаснууд (агаарын шугам, газар доорхи кабель гэх мэт). гэрт утас тавихыг зөвшөөрдөг. Хатуу төлөвт байгаа металлууд нь талст бүтэцтэй байдаг. Кристал дахь хэсгүүд нь орон зайн (талст) тор үүсгэдэг бөгөөд тэдгээрийн хоорондох зайд чөлөөт электронууд хөдөлдөг. Тэдний атомын цөмтэй холбоогүй байдаг чөлөөт электронуудын урсгалыг электрон хий гэж нэрлэдэг. Бүх чөлөөт электронуудын нийт сөрөг цэнэг нь бүх торны ионуудын эерэг цэнэгтэй тэнцүү байна. Эдгээр электронууд нь санамсаргүй дулааны хөдөлгөөнд оролцдог цахилгаан орон, чөлөөт электронууд дамжуулагчийн дагуу эмх цэгцтэй хөдөлж эхэлдэг. Метал дахь электронууд цахилгаан гүйдэл дамжуулагчийн үүрэг гүйцэтгэдэг болохыг 1899 онд Германы физикч Карл Рик энгийн туршилтаар нотолсон. Тэрээр ижил радиустай гурван цилиндрийг авчээ. , хөнгөн цагаан, зэсийг нэг нэгээр нь байрлуулж, тэдгээрийг төгсгөлүүдээр нь дарж, трамвайн шугамд оруулаад дараа нь нэг жил гаруй хугацаанд цахилгаан гүйдэл дамжуулж, металл цилиндрүүдийн холбоо барих цэгүүдийг шалгасан мөн зэс дэх хөнгөн цагааны атомыг олж чадаагүй, харин хөнгөн цагаанд зэсийн атом байхгүй, i.e. ямар ч тархалт байхгүй гэж тэр дүгнэсэн нь цахилгаан гүйдэл дамжуулагчаар дамжин өнгөрөхөд ионууд хөдөлгөөнгүй хэвээр үлдэж, зөвхөн чөлөөт электронууд хөдөлдөг бөгөөд энэ нь бүх бодисын хувьд ижил бөгөөд физик-химийн шинж чанаруудын ялгаатай холбоогүй юм. Тиймээс, металл дамжуулагчийн цахилгаан гүйдэл нь цахилгаан талбайн нөлөөн дор чөлөөт электронуудын захиалгат хөдөлгөөн юм. Энэ хөдөлгөөний хурд нь секундэд хэдэн миллиметр, заримдаа бүр бага байдаг дамжуулагч нь вакуум дахь гэрлийн хурдтай (300,000 fps) маш их хурдтайгаар хөдөлж, дамжуулагчийн бүх уртын дагуу тархаж, бүх электронууд нэг чиглэлд хөдөлж эхэлдэг дамжуулагчийн бүхэл бүтэн урт Тиймээс, жишээлбэл, цахилгаан чийдэнгийн хэлхээ хаагдах үед тэд эмх цэгцтэй хөдөлж, чийдэнгийн ороомог дахь электронууд байдаг. Тэд дамжуулагчийн цахилгаан гүйдлийн тархалтын хурдыг ярихдаа цахилгаан дохиог, жишээлбэл, Москвагаас Владивосток хүртэлх утаснуудын дагуу (ойролцоогоор 8000 км зайд) дамжуулдаг. ), тэнд ойролцоогоор 0.03 секундын дотор ирдэг. Диэлектрик буюу тусгаарлагч нь чөлөөт цэнэг зөөгч байхгүй, тиймээс тэдгээр нь цахилгаан гүйдэл дамжуулахгүй Ийм бодисыг хамгийн тохиромжтой диэлектрик гэж ангилдаг Эдгээр материалын ион бүтэцтэй, өөрөөр хэлбэл. эерэг ба сөрөг цэнэгтэй ионуудаас бүрдэх тэдгээрийн цахилгаан цэнэгүүд нь болор торонд холбогддог бөгөөд эдгээр материалыг диэлектрик болгодог. Бодит нөхцөлд диэлектрикүүд нь цахилгаан гүйдлийг маш сул дамжуулдаг Диэлектрикүүд нь тогтвортой молекулуудад холбогддог бөгөөд тэдгээр нь дамжуулагчийн адилаар тасрахад хялбар байдаг бөгөөд диэлектрикээр дамждаг цахилгаан гүйдэл нь цахилгаан талбайн хүчдэлтэй пропорциональ байдаг хүч чадал, цахилгааны эвдрэл үүсдэг. Энэ утгыг диэлектрикийн хүч чадал гэж нэрлэдэг бөгөөд V/см-ээр хэмжигддэг. Тэдний цахилгааны өндөр бат бэхийг голчлон цахилгаан тусгаарлагч материал болгон ашигладаг. Хагас дамжуулагч нь бага хүчдэлд цахилгаан гүйдэл дамжуулдаггүй, гэхдээ хүчдэл ихсэх үед цахилгаан дамжуулах чанар нь дамжуулагчаас (металлуудаас) ялгаатай нь температурын өсөлттэй холбоотой, жишээлбэл, ажиллахгүй байгаа транзистор радиод мэдэгдэхүйц юм халуун цаг агаарт сайн. Хагас дамжуулагч нь цахилгаан дамжуулах чанар нь гадны нөлөөллөөс ихээхэн хамааралтай байдаг тул цахилгаан дамжуулах чанарыг хянах боломжтой байдаг.
Даалгаврын каталог.
Даалгавар 3. Үелэх систем
Хариулт:
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Элементийн атомын тоо үе үе нэмэгдэхийн хэрээр атомын металл шинж чанар буурч, бүлгээр нь нэмэгддэг нь мэдэгдэж байна. Дараах элементүүдийг металлын шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг шаардлагатай дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Элементийн атомын тоо үе үе нэмэгдэхийн хэрээр атомын металл шинж чанар буурч, бүлгээр нь нэмэгддэг нь мэдэгдэж байна. Дараах элементүүдийг металлын шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул.
Элементүүдийн тэмдэглэгээг зөв дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Элементийн атомын тоо үе үе нэмэгдэхийн хэрээр атомын металл шинж чанар буурч, бүлгээр нь нэмэгддэг нь мэдэгдэж байна. Дараах элементүүдийг металлын шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул.
Элементүүдийн тэмдэглэгээг зөв дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Элементийн атомын тоо үе үе нэмэгдэхийн хэрээр атомын металл шинж чанар буурч, бүлгээр нь нэмэгддэг нь мэдэгдэж байна. Дараах элементүүдийг металлын шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул.
Элементүүдийн тэмдэглэгээг зөв дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Элементийн атомын тоо үе үе нэмэгдэхийн хэрээр атомын металл шинж чанар буурч, бүлгээр нь нэмэгддэг нь мэдэгдэж байна. Дараах элементүүдийг металлын шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул.
Элементүүдийн тэмдэглэгээг зөв дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Элементийн атомын тоо үе үе нэмэгдэхийн хэрээр атомын металл шинж чанар буурч, бүлгээр нь нэмэгддэг нь мэдэгдэж байна. Дараах элементүүдийг металлын шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг шаардлагатай дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Элементийн атомын тоо үе үе нэмэгдэхийн хэрээр атомын металл шинж чанар буурч, бүлгээр нь нэмэгддэг нь мэдэгдэж байна. Дараах элементүүдийг металлын шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул.
Элементүүдийн тэмдэглэгээг зөв дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Элементийн атомын тоо үе үе нэмэгдэхийн хэрээр атомын металл шинж чанар буурч, бүлгээр нь нэмэгддэг нь мэдэгдэж байна. Дараах элементүүдийг металлын шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул.
Элементүүдийн тэмдэглэгээг зөв дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдгүүдийг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг багасгах дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг хүссэн дарааллаар нь бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын цахилгаан сөрөг чанар нэмэгдэж, бүлгүүдэд буурдаг.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг цахилгаан сөрөг чанарыг нэмэгдүүлэх дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг зөв дарааллаар бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын цахилгаан сөрөг чанар нэмэгдэж, бүлгүүдэд буурдаг.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг цахилгаан сөрөг чанарыг бууруулах дарааллаар байрлуул: Элементүүдийн тэмдэглэгээг зөв дарааллаар бич.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Эдгээр хэв маягийг харгалзан өндөр ислийн хүчиллэг шинж чанарыг нэмэгдүүлэхийн тулд дараах элементүүдийг байрлуул: Элементүүдийн тэмдэглэгээг шаардлагатай дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, элементийн өндөр ислийн хүчиллэг шинж чанар нь цөмийн цэнэг нэмэгдэх тусам нэмэгдэж, бүлгээр буурдаг болохыг мэддэг.
Эдгээр зүй тогтлыг харгалзан өндөр ислийн хүчиллэг шинж чанарыг сулруулах дарааллаар дараах элементүүдийг байрлуул: Элементүүдийн тэмдэглэгээг шаардлагатай дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, хүчил гэдгийг мэддэг
Хүчилтөрөгчгүй хүчлүүдийн шинж чанар нь атомын цөмийн цэнэгийг үе ба бүлгээр нэмэгдүүлэх тусам нэмэгддэг.
Эдгээр хэв маягийг харгалзан устөрөгчийн нэгдлүүдийг хүчиллэг шинж чанарыг нэмэгдүүлэх дарааллаар байрлуул.
Хариултдаа химийн томъёоны тоог зөв дарааллаар зааж өгнө үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, цөмийн цэнэг нэмэгдэх үед элементүүдийн атомуудын электрон хандивлах хялбар байдал буурч, бүлгүүдэд нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан электрон алдагдлыг хөнгөвчлөхийн тулд дараах элементүүдийг байрлуул: Элементүүдийн тэмдэглэгээг шаардлагатай дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Химийн элементүүдийн үечилсэн систем D.I. Менделеев бол химийн элементүүд, тэдгээрийн шинж чанар, нэгдлүүдийн шинж чанар, эдгээр шинж чанаруудын өөрчлөлтийн зүй тогтол, бодисыг олж авах арга, түүнчлэн байгаль дахь байршлын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэх тусам атомын радиус буурч, бүлгээрээ нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараах элементүүдийг атомын радиусыг багасгах дарааллаар байрлуул: N, Al, C, Si. Элементүүдийн тэмдэглэгээг шаардлагатай дарааллаар бичнэ үү.
Хариултдаа элементүүдийн тэмдэглэгээг & тэмдэгээр тусгаарлана. Жишээлбэл, 11 ба 22.
Хариулт:
Химийн элементүүдийн үечилсэн систем D.I. Менделеев бол химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанарын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн дарааллын тоо нэмэгдэхийн хэрээр ислийн үндсэн шинж чанар нь үе үе буурч, бүлгээр нэмэгддэг гэдгийг мэддэг.
Эдгээр хэв маягийг харгалзан оксидын суурь чанарыг нэмэгдүүлэх дарааллаар дараах элементүүдийг байрлуул: Na, Al, Mg, B. Элементүүдийн тэмдгийг хүссэн дарааллаар нь бич.
Хариулт:
Химийн элементүүдийн үечилсэн систем D.I. Менделеев бол химийн элементүүд, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанарын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн дарааллын тоо нэмэгдэхийн хэрээр ислийн үндсэн шинж чанар нь үе үе буурч, бүлгээр нэмэгддэг гэдгийг мэддэг. Эдгээр хэв маягийг харгалзан оксидын суурь чанарыг нэмэгдүүлэх дарааллаар дараах элементүүдийг байрлуул: Mg, Al, K, Ca. Элементүүдийн тэмдгийг зөв дарааллаар бич.
Хариулт:
Эдгээр хэв маягийг харгалзан цахилгаан сөрөг чанарыг нэмэгдүүлэх дарааллаар дараахь элементүүдийг байрлуул: хлор, цахиур, хүхэр, фосфор. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Эдгээр хэв маягийг харгалзан дараахь элементүүдийг бууруулах чадварыг нэмэгдүүлэх дарааллаар байрлуулна: кальци, натри, магни, кали. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Эдгээр хэв маягийг харгалзан дараахь элементүүдийг атомын радиусыг багасгах дарааллаар байрлуул: хөнгөн цагаан, нүүрстөрөгч, бор, цахиур. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Эдгээр хэв маягийг харгалзан тэдгээрийн өндөр ислийн хүчиллэг шинж чанарыг нэмэгдүүлэхийн тулд дараахь элементүүдийг байрлуулна: цахиур, хлор, фосфор, хүхэр. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үелэх систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр ислийн үндсэн шинж чанар нь үе үе суларч, бүлгээр эрчимжиж байгааг мэддэг.
Эдгээр хэв маягийг харгалзан тэдгээрийн ислийн үндсэн шинж чанарыг сулруулахын тулд дараах элементүүдийг зохион байгуул: хөнгөн цагаан, фосфор, магни, цахиур. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Pe-ri-o-di-che-skaya si-ste-ma hi-mi-che-skih elements-men D. I. Men-de-le-e-va - god-ga-toe дэлгүүр -Химийн элементүүдийн талаар дэлгэрэнгүй мэдээлэл, тэдгээрийн шинж чанар, тэдгээрийн нэгдлүүдийн шинж чанарууд. Жишээлбэл, хи-ми-че-элементүүдийн тоо нэмэгдэхийн хэрээр пе-ри-о-дах уси-ли-ва дахь өндөр гидро-чулуулаг-си-д-ийн хүчиллэг шинж чанар нэмэгддэг нь мэдэгдэж байна. -et-sya, мөн бүлгүүдэд илжиг-be-va- et.
Эдгээр хуулиудыг зааж, тэдгээрийн өндөр гидридийн хүчиллэг шинж чанарыг сайжруулахын тулд тэдгээрийг шийдвэрлэх: нүүрстөрөгч-ле-саваа, бор, берилл-лиум, азот. Үүнтэй холбогдуулан теле-но-сти-ийн дараа шаардлагатай элементүүдийн тэмдгүүд байдаг.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үелэх систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн дарааллын тоо нэмэгдэхийн хэрээр гидроксидын үндсэн шинж чанар нь үе үе суларч, бүлгээр нэмэгддэг болохыг мэддэг.
Эдгээр хэв маягийг харгалзан тэдгээрийн гидроксидын үндсэн шинж чанарыг бэхжүүлэхийн тулд дараахь элементүүдийг байрлуулна: кальци, бериллий, стронций, магни. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр атомуудын электрон хүлээн авах чадвар - электрон сөрөг чанар нь үе үе нэмэгдэж, бүлгээрээ сулардаг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан цахилгаан сөрөг чанарыг бууруулах дарааллаар дараах элементүүдийг байрлуул: азот, хүчилтөрөгч, бор, нүүрстөрөгч. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр атомуудын электрон өгөх чадвар - багасгах чадвар нь үе үе суларч, бүлгээр нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараахь элементүүдийг багасгах чадварыг сулруулах дарааллаар байрлуул: азот, фтор, нүүрстөрөгч, хүчилтөрөгч. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр үе дэх атомын радиус буурч, бүлгээр нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараахь элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: хүчилтөрөгч, фтор, хүхэр, хлор. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр өндөр ислийн хүчиллэг шинж чанар нь үе үе нэмэгдэж, бүлгээр суларч байгааг мэддэг.
Цахиур, хлор, фосфор, хүхэр зэрэг өндөр оксидын хүчиллэг шинж чанарыг сулруулахын тулд эдгээр хэв маягийг харгалзан дараах элементүүдийг байрлуулна. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Эдгээр хэв маягийг харгалзан тэдгээрийн ислийн үндсэн шинж чанарыг бэхжүүлэхийн тулд дараах элементүүдийг зохион байгуул: хөнгөн цагаан, натри, магни, цахиур. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үелэх систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн дарааллын тоо нэмэгдэхийн хэрээр өндөр гидроксидын (хүчил) хүчиллэг шинж чанар нь үе үе нэмэгдэж, бүлгээр суларч байгааг мэддэг.
Эдгээр хэв маягийг харгалзан тэдгээрийн өндөр гидроксидын хүчиллэг шинж чанарыг сулруулахын тулд дараахь элементүүдийг байрлуул: нүүрстөрөгч, бор, бериллий, азот. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр атомуудын электрон хүлээн авах чадвар - электрон сөрөг чанар нь үе үе нэмэгдэж, бүлгээрээ сулардаг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан цахилгаан сөрөг чанарыг нэмэгдүүлэх дарааллаар дараахь элементүүдийг байрлуул: азот, фтор, нүүрстөрөгч, хүчилтөрөгч. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үелэх систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр электрон өгөх чадвар - багасгах чадвар нь үе үе суларч, бүлгээр нэмэгддэг.
Эдгээр хэв маягийг харгалзан дараахь элементүүдийг багасгах чадварыг нэмэгдүүлэх дарааллаар байрлуулна: рубиди, натри, лити, кали. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр үе дэх атомын радиус буурч, бүлгээр нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараахь элементүүдийг атомын радиусыг багасгах дарааллаар байрлуул: фосфор, нүүрстөрөгч, азот, цахиур. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр өндөр ислийн хүчиллэг шинж чанар нь үе үе нэмэгдэж, бүлгээр суларч байгааг мэддэг.
Эдгээр хэв маягийг харгалзан тэдгээрийн өндөр ислийн хүчиллэг шинж чанарыг нэмэгдүүлэхийн тулд дараах элементүүдийг байрлуул: хөнгөн цагаан, хүхэр, цахиур, фосфор. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үелэх систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр ислийн үндсэн шинж чанар нь үе үе суларч, бүлгээр нэмэгддэг болохыг мэддэг.
Эдгээр хэв маягийг харгалзан дараахь элементүүдийг тэдгээрийн ислийн үндсэн шинж чанарыг сулруулах дарааллаар байрлуулна: магни, кали, натри, кальци. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр үе дэх атомын радиус буурч, бүлгээр нэмэгддэг нь мэдэгдэж байна.
Эдгээр хэв маягийг харгалзан дараахь элементүүдийг атомын радиусыг нэмэгдүүлэх дарааллаар байрлуул: нүүрстөрөгч, бор, бериллий, азот. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеев 2019 оныг Химийн элементүүдийн үелэх системийн олон улсын жил болгон зарласан. 1869 онд Д.И.Менделеев Химийн элементийн үечилсэн хуулийг нээсний 150 жилийн ойг дэлхийн шинжлэх ухааны нийгэмлэг тэмдэглэнэ. Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр үе дэх атомын радиус буурч, бүлгээр нэмэгддэг нь мэдэгдэж байна. Эдгээр хэв маягийг харгалзан дараахь элементүүдийг атомын радиусыг багасгах дарааллаар байрлуул: хөнгөн цагаан, фосфор, цахиур. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
Хариулт:
Д.И.Менделеев 2019 оныг Химийн элементүүдийн үелэх системийн олон улсын жил болгон зарласан. 1869 онд Д.И.Менделеев Химийн элементийн үечилсэн хуулийг нээсний 150 жилийн ойг дэлхийн шинжлэх ухааны нийгэмлэг тэмдэглэнэ. Д.И.Менделеевийн химийн элементүүдийн үечилсэн систем нь химийн элементүүд, тэдгээрийн шинж чанарууд, тэдгээрийн нэгдлүүдийн шинж чанаруудын талаархи мэдээллийн баялаг сан юм. Жишээлбэл, химийн элементийн атомын тоо нэмэгдэхийн хэрээр өндөр ислийн хүчиллэг шинж чанар нь үе үе нэмэгдэж, бүлгээр суларч байгааг мэддэг. Эдгээр хэв маягийг харгалзан тэдгээрийн өндөр ислийн хүчиллэг шинж чанарыг нэмэгдүүлэхийн тулд дараах элементүүдийг байрлуул: хлор, фосфор, хүхэр. Хариултдаа элементүүдийн тэмдгийг зөв дарааллаар бичнэ үү.
1-Р ХЭСЭГ
1. Металл (M) байрладаг I-III бүлэгт, эсвэл IV-VI бүлгийн доод хэсэгт. В бүлгүүд нь зөвхөн металлаас бүрддэг.
2. Металлын атомууд гаднах электрон давхаргад 1-3 электронтой, атомын радиус харьцангуй том байна.Металлын атомууд гадаад электроноо алдах хандлагатай байдаг.
3. Энгийн бодисууд- металлууд нь металл химийн холбоогоор холбогдсон элементүүдээс бүрдэх бөгөөд үүнийг ерөнхий диаграмаар дүрсэлж болно.
4. Бүх M нь хатуу биет юм, Hg-ээс бусад. Хамгийн зөөлөн металлууд нь IA бүлэг, хамгийн хатуу нь Cr.
5. М нь дулаан ба цахилгаан дамжуулах чадвартаймөн металл гялбаатай.
6. Цагаан тугалга нь хоёр энгийн бодис үүсгэх шинж чанартай- цагаан ба саарал, өөрөөр хэлбэл аллотропийн шинж чанар.
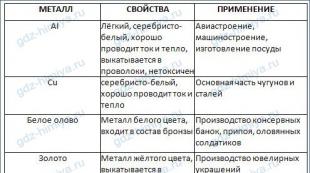
7. “Зарим металлын шинж чанар, хэрэглээ” хүснэгтийг бөглөнө үү.

2-Р ХЭСЭГ
1. Энгийн бодисуудын нэрийг сонгоно уу - металл. Зөв хариулттай тохирох үсгүүдийг ашигласнаар та металлын нэрийг үүсгэх бөгөөд энэ нь Грек хэлээр "чулуу" гэсэн утгатай: литий.
2) магни L
3) кальци I
5) зэс Т
7) алт I
8) мөнгөн ус Ж
2. Металлыг тодорхойлсон дараах мэдэгдлүүд буруу байна.
5) хуванцар биш, уян хатан биш
3. Жагсаалтаас хамгийн цахилгаан дамжуулагч дөрвөн металлыг сонго (тоонуудыг цахилгаан дамжуулах чанарын буурах дарааллаар байрлуул).
1) мөнгө
2) алт
3) хөнгөн цагаан
4) төмөр
5) манган
6) кали
7) натри
Хариулт: 1, 2, 3, 7.
4. Бодисын металл химийн холбоо үүсэх диаграммыг томъёогоор хий.

5. “Металл болор тор” зурагт дүн шинжилгээ хий.

Металлын хуванцар, дулаан, цахилгаан дамжуулах чадварын шалтгаануудын талаар дүгнэлт гарга.
Металлын атом бүр найман хөрш атомаар хүрээлэгдсэн байдаг. Салсан гадаад электронууд нь үүссэн нэг ионоос нөгөөд чөлөөтэй шилжиж, металлын ион цөмийг аварга молекул болгон холбодог. Металлын өндөр дулаан дамжуулалт ба цахилгаан дамжуулах чанар нь тэдний талст торонд цахилгаан талбайн нөлөөн дор хөдөлдөг хөдөлгөөнт электронууд байдагтай холбоотой юм. Ихэнх металлууд нь металлын атомын давхаргууд хоорондын холбоог таслахгүйгээр шилждэг тул уян хатан байдаг.
6. "Металл" хүснэгтийг бөглөнө үү. Интернэт зэрэг мэдээллийн нэмэлт эх сурвалжийг ашиглан хүснэгтийн өгөгдлийг хайж олох.

7. Интернэт болон бусад мэдээллийн эх сурвалжийг ашиглан дараах төлөвлөгөөний дагуу “Хүний амьдралд мөнгөн ус” сэдвээр богино мэдээ бэлтгэнэ.
1) эртний болон дундад зууны үеийн мөнгөн усны талаархи мэдлэг;
2) мөнгөн усны хоруу чанар, түүнтэй ажиллахдаа аюулгүй байдлын арга хэмжээ;
3) орчин үеийн үйлдвэрлэлд мөнгөн усны хэрэглээ.
1) Мөнгөн ус нь 7 металлын нэг байсан бөгөөд энэ нь зөвхөн мөнгөн ус төдийгүй түүний хайлш болох cinnabar-ыг ашигладаг байсан.
2) Маш хортой, өрөөний температурт ууршдаг, амьсгалсан тохиолдолд хүнийг хордуулдаг. Бие махбодид хуримтлагдаж, дотоод эрхтнүүд, амьсгалын зам, гематопоэтик эрхтэн, тархинд нөлөөлдөг.
3) Мөнгөн ус маш өргөн хэрэглэгддэг. Химийн үйлдвэрт натрийн гидроксид үйлдвэрлэхэд катод, олон органик нэгдлүүдийг үйлдвэрлэхэд катализатор, ураны блокуудыг уусгахад (цөмийн энергид). Энэ элементийг флюресцент чийдэн, кварц ламп, даралт хэмжигч, термометр болон бусад шинжлэх ухааны багаж хэрэгсэл үйлдвэрлэхэд ашигладаг.
И.В.ТРИГУБЧАК
Химийн багш
ХИЧЭЭЛ 6
10-р анги(сургалтын эхний жил)
Үргэлжлэл. Эхлэхийн тулд No 22/2005; 1, 2, 3, 5/2006
Химийн холбоо. Бодисын бүтэц
Төлөвлөгөө
1. Химийн холбоо:
ковалент (туйлтгүй, туйлт; дан, давхар, гурвалсан);
ионы; металл; устөрөгч; молекул хоорондын харилцан үйлчлэлийн хүч.
2. Кристал тор (молекул, ион, атом, металл).
Өөр өөр бодисууд өөр өөр бүтэцтэй байдаг. Өнөөдрийг хүртэл мэдэгдэж байгаа бүх бодисуудаас зөвхөн инертийн хий нь чөлөөт (тусгаарлагдсан) атом хэлбэрээр байдаг бөгөөд энэ нь тэдний электрон бүтцийн өндөр тогтвортой байдалтай холбоотой юм. Бусад бүх бодисууд (мөн тэдгээрийн 10 сая гаруй нь одоогоор мэдэгдэж байгаа) нэгдмэл атомуудаас бүрддэг.
Химийн холбоо гэдэг нь молекулууд, ионууд, чөлөөт радикалууд, түүнчлэн ион, атом, металлын талст тор үүсэхэд хүргэдэг атомууд эсвэл атомын бүлгүүдийн хоорондын харилцан үйлчлэлийн хүч юм.. Байгалийн хувьд химийн холбоо нь цахилгаан статик хүч юм. Атомуудын хооронд химийн холбоо үүсгэх гол үүрэг нь тэд юм валентын электронууд, өөрөөр хэлбэл цөмтэй хамгийн бага нягт холбогдсон гадаад түвшний электронууд. Атомын төлөвөөс молекул төлөвт шилжих үед гадаад электрон түвшний чөлөөт тойрог замыг тодорхой тогтвортой байдалд электроноор дүүргэхтэй холбоотой энерги ялгардаг.
Төрөл бүрийн химийн холбоо байдаг.
Ковалентын холбоо нь электрон хосуудыг хуваалцах замаар үүсдэг химийн холбоо юм. Ковалентын бондын онолыг 1916 онд Америкийн эрдэмтэн Гилберт Льюис дэвшүүлсэн. Ихэнх молекулууд, молекулын ионууд, чөлөөт радикалууд болон атомын болор сүлжээнүүд нь ковалент холбоогоор үүсдэг. Ковалентын холбоо нь урт (атом хоорондын зай), чиглэл (химийн холбоо үүсэх үед электрон үүлний тодорхой орон зайн чиг баримжаа), ханалт (атомуудын тодорхой тооны ковалент холбоо үүсгэх чадвар), энерги ( химийн холбоог таслахад зарцуулагдах эрчим хүчний хэмжээ).
Ковалентын холбоо байж болно туйлшралгүйТэгээд туйл. Туйл бус ковалент холбооижил электрон сөрөг (EO) атомуудын хооронд үүсдэг (H 2, O 2, N 2 гэх мэт). Энэ тохиолдолд нийт электрон нягтын төв нь хоёр атомын цөмөөс ижил зайд байна. Нийтлэг электрон хосуудын тоо (жишээлбэл, олон талт) дээр үндэслэн дан, давхар, гурвалсан ковалент холбоог ялгадаг. Хэрэв хоёр атомын хооронд зөвхөн нэг хос электрон хос үүссэн бол ийм ковалент холбоог нэг холбоо гэнэ. Хэрэв хоёр атомын хооронд хоёр буюу гурван нийтлэг электрон хос үүсвэл олон бонд үүсдэг - давхар ба гурвалсан. Давхар бонд нь нэг бонд ба нэг бондоос бүрдэнэ. Гурвалсан бонд нь нэг бонд, хоёр бондоос бүрдэнэ.
Атомын цөмүүдийг холбосон шугаман дээр давхцаж буй электрон үүлний талбайг үүсгэх ковалент холбоог гэнэ. - холболтууд. Атомын цөмийг холбосон шугамын хоёр талд давхцаж буй электрон үүлний талбай үүсдэг ковалент холбоог - гэж нэрлэдэг. холболтууд.
Холболт үүсгэхэд оролцож болно с- Тэгээд с-электронууд (H 2), с- Тэгээд х- электрон (HCl), Р- Тэгээд
Р-электронууд (Cl 2). Нэмж дурдахад "цэвэр" ба эрлийз орбиталуудын давхцлын улмаас -бонд үүсч болно. Зөвхөн Р- Тэгээд г- электронууд.
Дараах мөрүүд нь устөрөгч, хүчилтөрөгч, азотын молекул дахь химийн холбоог харуулав.
Энд хос цэгүүд (:) хосолсон электронууд; "загалмай" (x) - хосгүй электронууд.
Хэрэв өөр өөр ЭО-той атомуудын хооронд ковалент холбоо үүссэн бол нийт электрон нягтын төв нь илүү өндөр ЭО-той атом руу шилждэг. Энэ тохиолдолд байдаг ковалент туйлын холбоо. Ковалентын туйлын холбоогоор холбогдсон хоёр атомт молекул нь диполь буюу эерэг ба сөрөг цэнэгийн төвүүд бие биенээсээ тодорхой зайд байрладаг цахилгаан саармаг систем юм.
Устөрөгчийн хлорид ба усны молекул дахь химийн бондын график дүрслэл нь дараах байдалтай байна.
Энд сумнууд нь нийт электрон нягтын шилжилтийг заана.
Туйлт ба туйлт бус ковалент холбоо нь солилцооны механизмаар үүсдэг. Үүнээс гадна, байдаг донор хүлээн авагч ковалент холбоо.Тэдний үүсэх механизм нь өөр өөр байдаг. Энэ тохиолдолд нэг атом (донор) нь дан электрон хосоор хангадаг бөгөөд энэ нь өөрөө болон өөр атом (хүлээн авагч) хооронд хуваалцсан электрон хос болдог. Ийм холбоо үүсгэх үед хүлээн авагч нь чөлөөт электрон тойрог замыг хангадаг.
Ковалентын холбоо үүсэх донор-хүлээн авагч механизмыг аммонийн ион үүсэх жишээн дээр үзүүлэв.

Тиймээс аммонийн ион дахь дөрвөн холбоо бүгд ковалент байна. Үүний гурав нь солилцооны механизмаар, нэг нь донор-хүлээн авагч механизмаар үүсдэг. Дөрвөн холболтууд бүгд ижил төстэй бөгөөд үүнээс үүдэлтэй sp 3 -азотын атомын орбиталуудын эрлийзжилт. Аммонийн ион дахь азотын валент нь IV, учир нь Энэ нь дөрвөн холбоо үүсгэдэг. Иймээс хэрэв элемент нь солилцооны болон донор-хүлээн авагч механизмын аль алинаар нь холбоо үүсгэдэг бол түүний валент нь хосгүй электронуудын тооноос их байх ба гаднах электрон давхарга дахь орбиталуудын нийт тоогоор тодорхойлогддог. Ялангуяа азотын хувьд хамгийн өндөр валент нь дөрөв байна.
Ионы холбоо – цахилгаан статик таталцлын хүчний улмаас ионуудын хоорондох химийн холбоо. Их хэмжээний EO зөрүүтэй атомуудын хооронд ионы холбоо үүсдэг (> 1.7); өөрөөр хэлбэл энэ нь ердийн металл ба ердийн металл бус хоёрын хоорондох холбоо юм. Ионы холболтын онолыг 1916 онд Германы эрдэмтэн Вальтер Коссель дэвшүүлсэн. Металлын атомууд электроноо өгснөөр эерэг цэнэгтэй ион болж хувирдаг. катионууд; Металл бус атомууд электрон хүлээн авч сөрөг цэнэгтэй ион болж хувирдаг. анионууд. Үүссэн ионуудын хооронд электростатик таталцал үүсдэг бөгөөд үүнийг ионы холбоо гэж нэрлэдэг. Ионы холбоо нь чиглэлгүй, ханасан бус байдлаар тодорхойлогддог; Ионы нэгдлүүдийн хувьд "молекул" гэсэн ойлголт нь утгагүй юм. Ионы нэгдлүүдийн талст торонд ион бүрийн эргэн тойронд эсрэг цэнэгтэй тодорхой тооны ионууд байдаг. NaCl ба FeS нэгдлүүд нь куб болор тороор тодорхойлогддог.
Ионы холбоо үүсэхийг натрийн хлоридын жишээ болгон доор үзүүлэв.

Ионы холбоо нь туйлын ковалент бондын онцгой тохиолдол юм. Тэдгээрийн хооронд хурц хил байдаггүй; атомуудын хоорондох холбоо нь элементүүдийн электрон сөрөг байдлын ялгаагаар тодорхойлогддог.
Энгийн бодисууд болох металлууд үүсэх үед атомууд электронууд гаднах электрон түвшнээс амархан татгалздаг. Тиймээс металлын талстуудад тэдгээрийн зарим атомууд ионжсон төлөвт байдаг. Кристал торны зангилаанууд дээр эерэг цэнэгтэй металлын ион ба атомууд байх ба тэдгээрийн хооронд болор тороор чөлөөтэй хөдөлж чаддаг электронууд байдаг. Эдгээр электронууд нь металлын бүх атом, ионуудад нийтлэг болж, "электрон хий" гэж нэрлэгддэг. Металл болор торны бүх эерэг цэнэгтэй металл ион ба чөлөөт электронуудын хоорондын холбоог гэнэ. металл холбоо.
Металл холбоо байгаа эсэх нь метал ба хайлшийн физик шинж чанарыг тодорхойлдог: хатуулаг, цахилгаан дамжуулалт, дулаан дамжуулалт, уян хатан чанар, уян хатан чанар, металл гялбаа. Чөлөөт электронууд нь дулаан, цахилгааныг зөөвөрлөх чадвартай тул металыг металл бусаас ялгах үндсэн физик шинж чанаруудын шалтгаан болдог - өндөр цахилгаан ба дулаан дамжуулалт.
Устөрөгчийн холбооустөрөгч агуулсан молекулууд ба өндөр EO (хүчилтөрөгч, фтор, азот) бүхий атомуудын хооронд үүсдэг. H–O, H–F, H–N ковалент холбоо нь маш туйлттай тул устөрөгчийн атом дээр илүүдэл эерэг цэнэг, эсрэг туйл дээр илүүдэл сөрөг цэнэг хуримтлагддаг. Эсрэг цэнэгтэй туйлуудын хооронд электростатик таталцлын хүч - устөрөгчийн холбоо үүсдэг. Устөрөгчийн холбоо нь молекул хоорондын болон молекул доторх байж болно. Устөрөгчийн бондын энерги нь ердийн ковалент бондын энергиэс ойролцоогоор арав дахин бага боловч устөрөгчийн холбоо нь физик-химийн болон биологийн олон процесст чухал үүрэг гүйцэтгэдэг. Ялангуяа ДНХ-ийн молекулууд нь хоёр нуклеотидын гинж нь устөрөгчийн холбоогоор холбогдсон хос мушгиа юм.
Хүснэгт
| Кристал торны онцлог | Торны төрөл | |||
|---|---|---|---|---|
| Молекул | Ионик | Цөмийн | Металл | |
| Торны зангилааны хэсгүүд | Молекулууд | Катион ба анионууд | Атомууд | Металлын катион ба атомууд |
| Бөөмүүдийн хоорондын холболтын шинж чанар | Молекул хоорондын харилцан үйлчлэлийн хүч (устөрөгчийн холбоо орно) | Ионы холбоо | Ковалент холбоо | Металл холболт |
| Бондын хүч | Сул дорой | Удаан эдэлгээтэй | Маш бат бөх | Төрөл бүрийн хүч чадал |
| Бодисын өвөрмөц физик шинж чанарууд | Бага хайлах буюу сублиматор, хатуулаг бага, усанд олон уусдаг | Галд тэсвэртэй, хатуу, олон усанд уусдаг. Уусмал ба хайлмал нь цахилгаан гүйдэл дамжуулдаг | Маш галд тэсвэртэй, маш хатуу, усанд бараг уусдаггүй | Өндөр цахилгаан ба дулаан дамжуулалт, металл гялбаа |
| Бодисын жишээ | Иод, ус, хуурай мөс | Натрийн хлорид, калийн гидроксид, барийн нитрат | Алмаз, цахиур, бор, германий | Зэс, кали, цайр, төмөр |
Ус ба фторын устөрөгчийн молекулуудын хоорондох молекул хоорондын устөрөгчийн холбоог дараах байдлаар (цэгээр) дүрсэлж болно.

Устөрөгчийн холбоо бүхий бодисууд нь молекулын болор тортой байдаг. Устөрөгчийн холбоо байгаа нь молекулын холбоо үүсэхэд хүргэдэг бөгөөд үүний үр дүнд хайлах, буцалгах цэгүүд нэмэгддэг.
Химийн бондын үндсэн төрлөөс гадна аливаа молекулуудын хоорондын харилцан үйлчлэлийн бүх нийтийн хүч байдаг бөгөөд энэ нь шинэ химийн холбоог таслах, үүсгэхэд хүргэдэггүй. Эдгээр харилцан үйлчлэлийг ван дер Ваалсын хүч гэж нэрлэдэг. Эдгээр нь өгөгдсөн бодисын (эсвэл янз бүрийн бодисын) молекулуудын шингэн ба хатуу төлөв байдалд бие биедээ татагдах байдлыг тодорхойлдог.
Янз бүрийн төрлийн химийн холбоо нь янз бүрийн төрлийн болор сүлжээнүүд байгаа эсэхийг тодорхойлдог (хүснэгт).
Молекулуудаас бүрдэх бодисууд байдаг молекулын бүтэц. Эдгээр бодисуудад бүх хий, шингэн, түүнчлэн иод гэх мэт молекулын болор тортой хатуу бодисууд орно. Атом, ион эсвэл металл тортой хатуу биетүүд байдаг молекул бус бүтэц, тэдгээрт молекул байхгүй.
“Химийн холбоо. Бодисын бүтэц"
1. Аммиакийн молекулд химийн холбоо үүсэхэд хэдэн электрон оролцдог вэ?
a) 2; б) 6; 8 цагт; г) 10.
2. Ионы болор тортой хатуу биетүүд нь дараахь шинж чанартай байдаг.
a) хайлах цэг; б) холбох энерги;
в) усанд уусах чадвар; г) тогтворгүй байдал.
3. Доорх бодисуудыг ковалент холбоог нэмэгдүүлэх туйлшралын дарааллаар байрлуул. Хариултдаа үсгүүдийн дарааллыг заана уу.
a) S 8; b) SO 2; в) H 2 S; d) SF 6.
4. Ямар хэсгүүд натрийн нитратын талстыг үүсгэдэг вэ?
a) Na, N, O атомууд; б) ионууд Na +, N 5+, O 2-;
в) NaNO 3 молекулууд; d) Na +, NO 3 – ионууд.
5. Хатуу төлөвт атомын талст тортой бодисуудыг заана уу.
а) алмаз; б) хлор;
в) цахиурын (IV) исэл; г) кальцийн исэл.
6. Хамгийн их холболтын энергитэй молекулыг заана уу:
а) фтор устөрөгч; б) устөрөгчийн хлорид;
в) устөрөгчийн бромид; г) устөрөгчийн иодид.
7. Бүх холбоо нь ковалент байх хос бодисыг сонгоно уу:
a) NaCl, HCl; b) CO 2, NO;
в) CH 3 Cl, CH 3 K; d) SO 2, NO 2.
8. Бондын туйлшралыг нэмэгдүүлэх дарааллаар молекулууд аль эгнээнд байрладаг вэ?
a) HBr, HCl, HF; b) NH 3, PH 3, ASH 3;
в) H 2 Se, H 2 S, H 2 O; d) CO 2, CS 2, CSe 2.
9. Молекулууд нь олон тооны холбоо агуулсан бодисыг:
a) нүүрстөрөгчийн давхар исэл; б) хлор;
в) ус; г) этанол.
10. Молекул хоорондын устөрөгчийн холбоо үүсэхэд ямар физик шинж чанар нөлөөлдөггүй вэ?
a) цахилгаан дамжуулах чанар;
б) нягтрал;
в) буцлах цэг;
г) хайлах цэг.
Туршилтын түлхүүр
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б | Г | a B C D | Г | а, в | А | б, г | а, в | А | А |
Хий ба хийн хольцтой холбоотой асуудлууд
А түвшин
1. Хийн хүхрийн исэл нь 60 ° C температурт, 90 кПа даралттай 2.08 г / л нягттай байдаг. Оксидын томъёог тодорхойл.
Хариулах. SO2.
2. Агаар дахь харьцангуй нягт нь 0.1 бол холимог дахь устөрөгч ба гелийн эзлэхүүний хэсгийг ол.
Хариулах. 55% ба 45%.
3. Бид 50 литр устөрөгчийн сульфид ба хүчилтөрөгчийн холимогийг 16.2 харьцангуй устөрөгчийн нягттай шатаасан. Үүссэн бодисыг 25 мл 25% натрийн гидроксидын уусмалаар (уусмалын нягт нь 1280 кг / м3) дамжуулсан. Үүссэн хүчиллэг давсны массыг тодорхойлно.
Хариулах. 20.8 гр.
4. Натрийн нитрат ба кальцийн карбонатын холимог нь дулаанаар задарсан. Холимог дахь үүссэн хий (эзлэхүүн 11.2 л) харьцангуй устөрөгчийн нягтрал 16.5 байна. Эхний хольцын массыг тодорхойлно.
Хариулах. '82
5. Аргон ба азотын хэдэн молийн харьцаагаар агаарын нягттай тэнцүү хийн хольцыг гаргаж авах боломжтой вэ?
Анхны хольц нь Ar ба N 2 агуулдаг.
Асуудлын нөхцлийн дагуу (холимог) = (агаар).
М(агаар) = М(холимог) = 29 г/моль.
![]()
Ердийн харьцааг ашиглан:
бид дараах илэрхийлэлийг авна.
![]()
(Холимог) = 1 моль. Дараа нь (Ar) = Xмоль, (N 2) = (1 -) X) мэнгэ.

Хариулах. (Ar): (N 2) = 1: 11.
6. Азот ба хүчилтөрөгчөөс бүрдэх хийн хольцын нягт нь 1.35 г/л байна. Холимог дахь хийн эзлэхүүний эзлэхүүнийг % -аар ол.
Хариулах. 44% ба 56%.
7. Устөрөгч, хлор агуулсан хольцын хэмжээ 50 мл байна. Устөрөгчийн хлорид үүссэний дараа 10 мл хлор үлдэнэ. Анхны хольцын найрлагыг эзэлхүүний %-аар ол.
Хариулах. 40% ба 60%.
Хариулах. 3%.
9. Метан ба нүүрстөрөгчийн давхар ислийн ижил хэмжээтэй холимогт аль хий нэмэхэд түүний устөрөгчийн нягт: a) нэмэгдэх болно; б) буурах уу? Тохиолдол бүрт хоёр жишээ өг.
Хариулах.
М(CH 4 ба CO 2-ийн холимог) = 30 г / моль; a) Cl 2 ба O 2; b) N 2 ба H 2.
10.
Аммиак ба хүчилтөрөгчийн холимог байдаг. Энэ хольцонд аль хий нэмэхэд түүний нягт нь:
а) нэмэгдэх болно; б) буурах уу? Тохиолдол бүрт хоёр жишээ өг.
Хариулах.
17 < М Р(NH 3 + O 2 хольц)< 32; а) Cl 2
и C 4 H 10 ; б) H 2 и Нe.
11. Эхний хийн агууламж эзлэхүүний 35% байвал нүүрстөрөгчийн давхар исэл ба нүүрстөрөгчийн давхар ислийн хольцын 1 литр масс ямар байх вэ?
Хариулах. 1.7 гр.
12. 1 литр нүүрстөрөгчийн давхар исэл ба нүүрстөрөгчийн давхар ислийн холимог. 1.43 г масстай хольцын найрлагыг эзлэхүүнээр нь тодорхойлно.
Хариулах. 74.8% ба 25.2%.
Б түвшин
1. Агаарт агуулагдах бүх хүчилтөрөгч озон болж хувирвал азотын агаарын харьцангуй нягтыг тодорхойл (агаарт зөвхөн азот, хүчилтөрөгч агуулагддаг гэж үзье).
Хариулах. 1,03.
2. А хийтэй ижил нягттай В хий агуулсан шилэн саванд маш түгээмэл хий А-г оруулахад саванд зөвхөн нойтон элс үлдэнэ. Хийүүдийг тодорхойлох. Тэдгээрийг олж авах лабораторийн аргуудын тэгшитгэлийг бичнэ үү.
Хариулах. A – O 2, B – SiH 4.
2NaNO 3 2NaNO 2 + O 2,
Mg 2 Si + 4H 2 O = 2Mg(OH) 2 + SiH 4.
3. Хүхрийн давхар исэл ба хүчилтөрөгчөөс бүрдэх хийн хольцод устөрөгчийн хувьд харьцангуй нягт нь 24, хүхрийн давхар ислийн нэг хэсэг нь урвалд орж, анхны хольцын харьцангуй нягтаас 25% илүү устөрөгчийн харьцангуй нягттай хийн хольц үүссэн. . Тэнцвэрийн хольцын найрлагыг эзлэхүүний %-аар тооцоол.
Хариулах. 50% SO 3, 12.5% SO 2, 37.5% O 2.
4. Озоны дагуу озонжуулсан хүчилтөрөгчийн нягт 0.75 байна. 20 литр метаныг (н.о.) шатаахад хэдэн литр озонжуулсан хүчилтөрөгч шаардагдах вэ?
Хариулах. 35.5 л.
5. Хийн хольцоор дүүрсэн хоёр сав байдаг: a) устөрөгч ба хлор; б) устөрөгч ба хүчилтөрөгч. Эдгээр хольцоор цахилгаан оч дамжуулахад савны даралт өөрчлөгдөх үү?
Хариулах. a) өөрчлөгдөхгүй; б) буурах болно.
(CaSO 3) = 1 моль,
Дараа нь y= (Ca(HCO 3) 2) = 5 моль.

Үүссэн хийн хольц нь SO 2 ба CO 2 агуулдаг.

Хариулах. Дагаар (холимог) = 1.58.
7. Нүүрстөрөгчийн дутуу исэл ба хүчилтөрөгчийн хольцын эзэлхүүн нь 200 мл (n.s.) юм. Бүх нүүрстөрөгчийн дутуу ислийг шатааж, хэвийн байдалд оруулсны дараа. хольцын хэмжээ 150 мл хүртэл буурсан. Хийн хольцыг 50 г 2%-ийн калийн гидроксидын уусмалаар дамжуулсны дараа түүний хэмжээ хэдэн удаа буурах вэ?
Хариулах. 3 удаа.
А ХЭСЭГ. Олон сонголттой тестүүд
1. Литийн атом дахь энергийн түвшингээр электронуудын тархалт:
2. Шүлтлэг металлын атомын гаднах электрон давхаргын электронуудын тоо:
3. Натри энгийн бодис дахь химийн бондын төрөл:

4. Хамгийн тод металл шинж чанартай энгийн бодис:
5. Цөмийн цэнэг нэмэгдэж байгаа үндсэн дэд бүлгийн элементүүдийн атомын радиус:

6. Кальцийн атом нь кальцийн ионоос ялгаатай:

7. Устай хамгийн хүчтэй урвалд ордог:
8. Давсны хүчилтэй харьцдаггүй:
9. Хөнгөн цагааны гидроксид нь дараахь бодистой харилцан үйлчилдэг.
10. Бүх бодисууд төмөртэй урвалд ордог цуврал:

Б ХЭСЭГ. Чөлөөт хариулттай асуултууд
11. Кальцийн гидроксидыг авах гурван аргыг санал болго. Хариултаа урвалын тэгшитгэлээр баталгаажуулна уу.

12. X, Y, Z бодисуудыг тодорхойлж, химийн томъёог нь бич.

13. Аливаа урвалж (бодис) ба лити ашиглан исэл, суурь, давсыг хэрхэн яаж авах вэ? Урвалын тэгшитгэлийг молекул хэлбэрээр бичнэ үү.

14. Хөнгөн цагаан, хар тугалга, алт, зэс зэрэг металлуудыг харьцангуй цахилгаан дамжуулах чанарыг нэмэгдүүлэх дарааллаар байрлуул (Зураг 2).